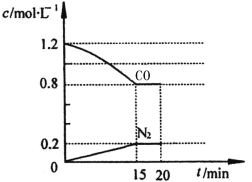
题目内容
【题目】已知:硫酸铜溶液中滴入氨基乙酸钠(H2N﹣CH2﹣COONa)即可得到配合物A.其结构如图1:

(1)Cu元素基态原子的外围电子排布式为 。
(2)元素C、N、O的第一电离能由大到小排列顺序为 。
(3)配合物A中碳原子的轨道杂化类型为 。
(4)1mol氨基乙酸钠(H2N﹣CH2﹣COONa)含有σ键的数目为 。
(5)氨基乙酸钠分解产物之一为二氧化碳,其结构如图2,它属于________晶体,每个CO2分子与________个CO2分子紧邻。写出二氧化碳的一种等电子体: (写化学式)。
(6) 已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图3,则该化合物的化学式是 。
【答案】(1)3d104s1 (2)N>O>C (3)sp3、sp2 (4)8NA
(5)分子 12 N2O(或SCN﹣、N3﹣等)(6)Cu2O.
【解析】
试题分析:(1)Cu是29号元素,其原子核外有29个电子,3d能级上有10个电子、4s能级上有1个电子,3d、4s能级上电子为其外围电子,根据构造原理知其基态原子外围电子排布式为3d104s1。
(2)同周期从左到右,元素的第一电离能呈增大趋势,但N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素,所以C、N、O三种元素的第一电离能由由小到大的排列顺序是N>O>C。
(3)配合物A分子中一种碳有C=O,碳的杂化方式为sp2杂化,另一种碳周围都是单键,碳的杂化方式为sp3杂化。
(4)共价单键为σ键,共价双键中一个是σ键一个是π键,H2N-CH2-COONa中含有8个σ键,所以1mol氨基乙酸钠中含有σ键的数目为8NA。
(5)二氧化碳属于分子晶体,每个CO2分子与12个CO2分子紧邻;一个二氧化碳分子中原子个数为3个,价电子数为16,原子个数相等、价电子数相等的微粒为等电子体,则CO2的等电子体为N2O(或SCN-、N3-等)。
(6)利用均摊法知,该化合物中O原子个数=1+8×1/8=2,Cu原子个数为4,铜原子和氧原子个数之比=4:2=2:1,所以其化学式为Cu2O。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案