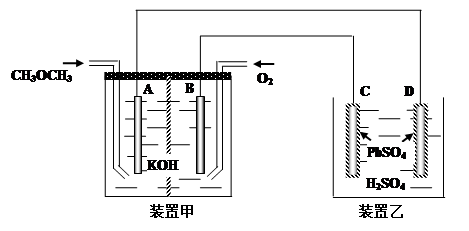
题目内容
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
Ⅰ.每空1分(1)黄;中和H+,使c(H+)减小,平衡向正反应方向移动
(2)橙红色;增加生成物c(H+),平衡向逆反应方向移动 (3)正反应(右) 变浅
Ⅱ.(1)①最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色 ②8.2~10 (2)0.1130mol/L(不写单位扣1分) (3)丙 (4)EF(2分)
解析试题分析:Ⅰ.(1)向上述溶液中加入NaOH溶液后,溶液中OH-浓度增大,中和氢离子,降低氢离子的浓度。则根据Cr2O72-+H2O  2CrO42-+2H+可知,平衡向正反应方向移动,所以溶液呈黄色。
2CrO42-+2H+可知,平衡向正反应方向移动,所以溶液呈黄色。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,增加生成物c(H+),平衡向逆反应方向移动因此溶液呈橙红色。
(3)向原溶液中加入Ba(NO3)2溶液,则Ba2+结合CrO42-生成BaCrO4黄色沉淀,降低CrO42-的浓度,所以平衡向正反应方向移动。由于离子的浓度降低,因此溶液颜色将变浅。
Ⅱ.(1)①由于碱能使酚酞显红色,而酸使酚酞不白色。所以用氢氧化钠溶液滴定盐酸时,滴定达到终点的现象是最后一滴氢氧化钠溶液加入,溶液由无色恰好变浅红色,且半分钟内不褪色、由于酚酞的变色范围是8.2~10.0,所以此时锥形瓶内溶液的pH范围为8.2~10.0。
(2)根据表中数据可知,三次实验中消耗氢氧化钠溶液的体积分别是22.62ml-0.10ml=22.52ml、22.58ml-0.10ml=22.48ml、22.60ml-0.10ml=22.50ml,所以三次实验中平均消耗氢氧化钠溶液的体积是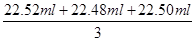 =22.50ml。因此盐酸的浓度是
=22.50ml。因此盐酸的浓度是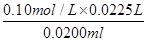 =0.1130mol/L。
=0.1130mol/L。
(3)由于碱式滴定管的下面是含有玻璃球的橡胶管,因此挤压玻璃球使尖嘴部分充满碱液的正确操作是选项丙。
(4)根据 可知,由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、滴定终点读数时俯视读数,则读数偏小,因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,则盐酸被稀释,浓度降低。因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;C、锥形瓶水洗后未干燥,不改变溶质的物质的量,不影响结果;D、配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,则实际所配的氢氧化钠溶液浓度偏高。因此中和盐酸时消耗氢氧化钠溶液的体积偏小,测定结果偏低;E、配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,则所配浓度偏低,所以中和盐酸时消耗氢氧化钠溶液的体积偏大,测定结果偏高;F、碱式滴定管尖嘴部分有气泡,滴定后消失,则实际消耗氢氧化钠溶液的体积偏大,测定结果偏高,所以答案选EF。
可知,由于C标、V待均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、滴定终点读数时俯视读数,则读数偏小,因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,则盐酸被稀释,浓度降低。因此消耗氢氧化钠溶液的体积偏小,测定结果偏低;C、锥形瓶水洗后未干燥,不改变溶质的物质的量,不影响结果;D、配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中,则实际所配的氢氧化钠溶液浓度偏高。因此中和盐酸时消耗氢氧化钠溶液的体积偏小,测定结果偏低;E、配制NaOH标准溶液时,定容时仰视容量瓶的刻度线,则所配浓度偏低,所以中和盐酸时消耗氢氧化钠溶液的体积偏大,测定结果偏高;F、碱式滴定管尖嘴部分有气泡,滴定后消失,则实际消耗氢氧化钠溶液的体积偏大,测定结果偏高,所以答案选EF。
考点:考查外界条件对平衡状态的影响;酸碱中和滴定操作、计算、误差分析

2012年11月16日,5名男孩被发现死于贵州省毕节市七星关区街头垃圾箱内,经当地公安部门初步调查,5名男孩是因在垃圾箱内生火取暖导致CO中毒而死亡。
(1)CO中毒是由于CO与血液中血红蛋白的血红素部分反应生成碳氧血红蛋白,反应的化学方程式可表示为CO+HbO2 O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的
O2+HbCO,实验表明,c(HbCO)即使只有c(HbO2)的 ,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的
,也可造成人的智力损伤。已知t ℃时上述反应的平衡常数K=200,吸入肺部O2的浓度约为1.0×10-2 mol·L-1,若使c(HbCO)小于c(HbO2)的 ,则吸入肺部CO的浓度不能超过________mol·L-1。
,则吸入肺部CO的浓度不能超过________mol·L-1。
(2)有如下三个与CO相关的反应:
Fe(s)+CO2(g) FeO(s)+CO(g) ΔH=Q1,平衡常数K1
FeO(s)+CO(g) ΔH=Q1,平衡常数K1
Fe(s)+H2O(g) FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
FeO(s)+H2(g) ΔH=Q2,平衡常数为K2
H2(g)+CO2(g) CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
CO(g)+H2O(g) ΔH=Q3,平衡常数为K3
在不同的温度下K1、K2、K3的数值如下:
| T/℃ | K1 | K2 | K3 |
| 700 | 1.47 | 2.38 | 0.62 |
| 900 | 2.15 | 1.67 | |
请回答下列问题:
①Q1、Q2、Q3的关系式:Q3=________。
②K1、K2、K3的关系式:K3=________,根据此关系式可计算出上表中900 ℃时,K3的数值为________(精确到小数点后两位)。可进一步推断反应H2(g)+CO2(g)??CO(g)+H2O(g)为________(填“放”或“吸”)热反应,Q3________0(填“>”、“<”或“=”)。③改变条件使可逆反应H2(g)+CO2(g)
 CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。
CO(g)+H2O(g)已经建立的平衡逆向移动,可采取的措施有________。A.缩小容器体积 B.降低温度 C.使用催化剂 D.设法增加H2O(g)的量
E.升高温度
(3)在一定条件下,使CO和O2的混合气体13 g充分反应,所得混合气体在常温下与足量的Na2O2固体反应,结果固体增重7 g,则原混合气体中CO的质量是________g。
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 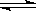 CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。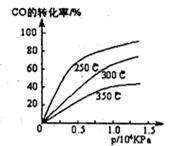
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
| D.重新平衡时n(H2)/n(CH3OH)增大 |
已知重铬酸钾(K2Cr2O7)是一种主要的的无机试剂。
(1)强氧化性的K2Cr2O7溶液中,存在如下平衡: Cr2O72-(橙色)+H2O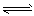 2CrO42-(黄色)+2H+,
2CrO42-(黄色)+2H+,
①若要使溶液的橙色加深,下列可采用的方法是 。
| A.加入适量稀盐酸 | B.加入适量稀硫酸 | C.加入适量烧碱固体 | D.加水稀释。 |
某学生为了探究锌与盐酸反应过程中速率变化。在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如下:
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
(1)在0~1、1~2、2~3、3~4、4~5 min时间段中,反应速率最大的时间段是 ,
原因为 ;反应速率最小的时间段是 ,
原因为 。(2)在2~3min时间段内,用盐酸的浓度变化表示的反应速率为 。
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入等体积的下列溶液:A .蒸馏水 B .Na2SO4溶液 C. NaNO3溶液 D. CuSO4溶液 E. Na2CO3 溶液, 你认为可行的是 。
 TaI4(g)+S2(g) (Ⅰ)
TaI4(g)+S2(g) (Ⅰ)
 CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
 CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示:
CH3OH(g) + H2O(g) △H =" -49.0" kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示: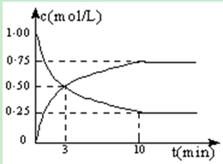

 CH3OCH3(g)+CO2(g) ΔH<0
CH3OCH3(g)+CO2(g) ΔH<0