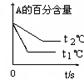
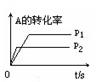
题目内容
工业上一般在密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g) 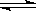 CH3OH(g)
CH3OH(g)
(1)不同温度下的平衡转化率与压强的关系如图所示。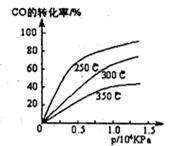
①该反应△H 0,△S 0(填“>”或“<”),则该反 自发进行(填“一定能”、“一定不能”、“不一定”)实际生产条件控制在250℃、l.3×l04kPa左右,选择此压强的理由是 。
(2)某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)="0.l" mol·L -1。
①该反应的平衡常数K= :
②在其他条件不变的情况下,将容器体积压缩到原来的1/2,与原平衡相比,下列有关说法正确的是 (填序号)。
| A.氢气的浓度减少 |
| B.正反应速率加快,逆反应速率也加快 |
| C.甲醇的物质的量增加 |
| D.重新平衡时n(H2)/n(CH3OH)增大 |
(1)①< <) 不一定 ②该压强下,CO转化率已较高(90%左右),再增大压强CO转化率提高不大,且生产成本增加 (2)① 6.25 ② b c ③ b = 2+2a 1.8<c ≤2
解析试题分析:(1)①由图可知:在压强不变的情况下:升高温度,CO的转化率降低,说明升高温度,化学平衡向逆反应方向移动。逆反应方向是吸热反应。正反应是放热反应。所以ΔH<0.在温度不变时,增大压强,CO的转化率增大。说明增大压强化学平衡向正反应方向移动。ΔS<0..由于正反应是一个体系混乱程度减小的放热反应,所以无法确定该反应能否自发进行。②选择此压强的理由是在该压强下,CO转化率已较高(90%左右),再增大压强,CO转化率虽然提高但提高不大,且生产成本增加的多,效益反而降低。(2)①反应开始时CO H2CH3OH的浓度分别是1mo/L 3mol/L 0mol/L,在反应过程中转化浓度分别是0.9mol/L 1.8mol/L 0.9mol/L.所以它们的平衡浓度分别是0.1mol/L 1.2mol/L 0.9mol/L所以达到化学平衡时平衡常数是K=(0.9)÷{0.1×(1.2)2}=" 6.25" ②将容器体积压缩到原来的1/2,化学平衡向正反应方向移动。与原平衡相比,正反应速率加快,逆反应速率也加快;各物质的浓度都增大,甲醇的物质的量也增加增加 ; D.重新平衡时n(H2)/n(CH3OH)减小。正确选项为:bc.③若保持同一反应温度将起始物质改为a mol CO、b mol H2、c mol CH30H,欲使平衡混合物中各组成与原平衡相同,则a、b应满足的关系为b=2+2a.假如物质时由CH3OH转化生成,则开始时n(CH3OH)=2mol,因为平衡时n(CH3OH)=0.9mol/L×2L=1.8mol.所以欲使开始时该反应向逆反应方向进行,c的取值范围是 1.8<c ≤2
考点:考查反应进行的方向和外界条件对化学平衡的影响的知识。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。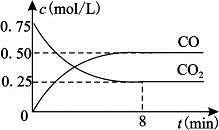
(1)下列措施中能使平衡时K增大的是___________(填序号);
A.升高温度 B.增大压强C.充入一定量COD.降低温度
(2)8分钟内,CO的平均反应速率v(CO)=___________mol/(L·min);
(3)1100℃时,2L的密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下
| 容器 | 甲 | 乙 |
| 反应物投入量 | 3molFe、2molCO2 | 4molFeO、3molCO |
| CO的浓度(mol/L) | C1 | C2 |
| CO2的体积分数 | 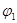 | 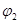 |
| 体系压强(Pa) | P1 | P2 |
| 气态反应物的转化率 | 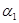 | 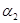 |
A.
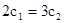 B.
B.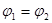 C.P1<P2D.
C.P1<P2D.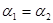
②求
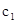 =___________、
=___________、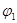 =___________、
=___________、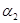 =___________。
=___________。 Ⅰ.(4分)在一体积为10L密闭的容器中,通入一定量的CO和H2O(g),在850℃时发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) △H<0
CO2(g)+H2(g) △H<0
(1)CO和H2O浓度变化如图,则0~4 min的平均反应速率ν(CO)=_______ mol/(L·min),此时该反应的平衡常数为 。 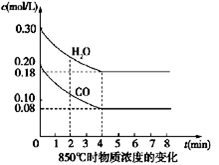
(2)当下列哪些物理量不再发生变化时,表明上述反应已达到平衡状态的是 。
| A.混合气体的压强 |
| B.混合气体的密度 |
| C.CO的物质的量浓度 |
| D.密闭容器中放出热量 |
Ⅱ.(6分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
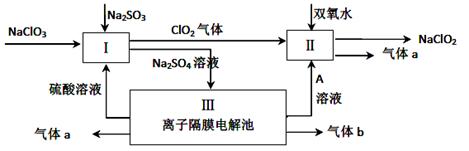
(3)配平Ⅰ中反应方程式 ClO3-+ H++ SO32-== ClO2↑+ SO42-+
(4)A的化学式是 ,。生成气体a的电极反应式 。
Ⅰ. 在水溶液中橙红色的Cr2O72-与黄色的CrO42-有下列平衡关系:
Cr2O72-+H2O  2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
2CrO42-+2H+,把K2Cr2O7溶于水配成稀溶液是橙色。
(1)向上述溶液中加入NaOH溶液后,溶液呈 色,因为 。
(2)向已加入NaOH溶液的(1)中再加入过量稀H2SO4后,则溶液呈 色,因为 。
(3)向原溶液中加入Ba(NO3)2溶液(已知BaCrO4为黄色沉淀)则平衡向 方向移动,溶液颜色将 。(填“变深”、“变浅”或“不变”)
Ⅱ.实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
1.配制100mL 0.10mol/L NaOH标准溶液。
2.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
3.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.58 | 20.00 |
| 3 | 0.10 | 22.60 | 20.00 |
(1)滴定达到终点的现象是 ,此时锥形瓶内溶液的pH范围为 。
(2)根据上述数据,可计算出该盐酸的浓度约为 。
(3)排去碱式滴定管中气泡的方法应采用下图 的操作,然后挤压玻璃球使尖嘴部分充满碱液。



甲 乙 丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有 (多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
氨气是一种重要的化工产品,是生产铵盐、尿素等的原料。工业合成氨的反应如下:N2(g) +3H2(g)  2NH3(g) △H=一92. 4 KJ·mol-1
2NH3(g) △H=一92. 4 KJ·mol-1
(1)2NH3(g)  N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
N2(g) +3H2(g)在恒容密闭容器中达到平衡的标志有
①单位时间内生成3n mol H2:同时生成2n mol NH3②用NH3、N2、H2表示反应速率比为2∶1∶3 ③混合气体的密度不再改变 ④混合气体压强不再改变 ⑤混合气体平均相对分子质量不再改变
| A.①③④ | B.①②④⑤ | C.①④⑤ | D.②③④ |
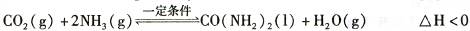
t℃时,向容积恒定为2L的密闭容器中加入0.10 molCO:和0. 40 molNH3 ,70 min开始达到平衡。反应中CO2 ( g)的物质的量随时间变化如下表所示:
| 时间/min | 0 | 30 | 70 | 80 | 100 |
| n(CO2) /mol | 0.10 | 0.060 | 0.040 | 0.040 | 0.040 |
①20 min时,υ正(CO2 )_ 80 min时。υ逆(H2O)(填“>”、“=”或“<”)。
②在100 min时,保持其它条件不变,再向容器中充入0. 050 mo1CO2和0. 20 molNH3,重新建立平衡后CO2的转化率与原平衡相比将_ (填“增大”、“不变”或“减小”)。
③上述可逆反应的平衡常数为_ (保留二位小数)。
④根据表中数据在图甲中绘制出在t℃下NH3的转化率随时间变化的图像;保持其它条件不变;则(t+10)℃下正确的图像可能是 (填图甲中的“A”或“B”)。
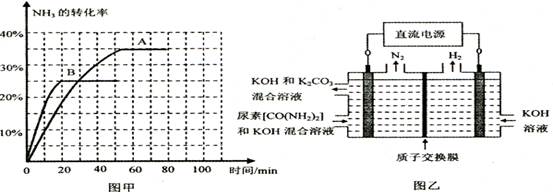
⑤图乙所示装置(阴、阳极均为惰性电极)可用于电解尿素〔CO(NH2)2〕的碱性溶液制取氢气。该装置中阳极的电极反应式为 ,若两极共收集到气体22. 4L(标
况),则消耗的尿素为 g(忽略气体的溶解)。
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件, 能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅, 其反应如下: 3SiCl4(g)+2N2(g)+6H2(g) Si3N4(s)+12HCl(g) ΔH <0
Si3N4(s)+12HCl(g) ΔH <0
完成下列填空:
(1)在一定温度下进行上述反应, 若反应容器的容积为2 L, 3 min后达到平衡, 测得固体质量增加了2. 80 g, 则转移电子的物质的量为 ,H2的平均反应速率为 mol/(L·min); 该反应的平衡常数表达式K= 。
(2)上述反应达到平衡后, 下列说法正确的是 。
a. 其他条件不变, 压强增大, 平衡常数K减小
b. 其他条件不变, 温度升高, 平衡常数K减小
c. 其他条件不变, 增大Si3N4物质的量,平衡向左移动
d. 其他条件不变, 增大HCl物质的量,平衡向左移动
(3)一定条件下, 在密闭恒容的容器中, 能表示上述反应达到化学平衡状态的是 。
| A.3v逆(N2)=v正(H2) | B.v正(HCl)=4v正(SiCl4) |
| C.混合气体密度保持不变 | D.c(N2)∶c(H2)∶c(HCl)=1∶3∶6 |
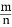 , 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比
, 保持其他条件不变, 降低温度后达到新的平衡时, H2和HCl的物质的量之比 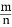 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。 铁及其化合物在生产、生活中应用广泛。
(1)一定条件下,Fe与CO2可发生反应:
2Fe(s)+3CO2(g) Fe2O3(s)+3CO(g)
Fe2O3(s)+3CO(g)
该反应的平衡常数(K ) 随温度(T ) 升高而增大。
①该反应的平衡常数K=______。(填表达式)
②下列措施中,能使平衡时c(CO)/c(CO2) 增大的是 (填标号)。
| A.升高温度 | B.增大压强 |
| C.充入一定量CO | D.再加一些铁粉 |
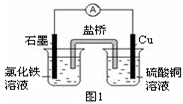
(3)图2装置中甲烧杯盛放100 mL 0.2 mol/L的NaCl溶液,乙烧杯盛放100 mL 0.5 mol/L的CuSO4溶液。反应一段时间后,停止通电。向甲烧杯中滴入几滴酚酞溶液,观察到石墨电极附近首先变红。
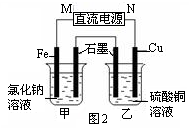
① 电源的M端为 极,甲烧杯中铁电极的电极反应为 。
② 乙烧杯中电解反应的化学方程式为 。
③ 停止电解,取出Cu电极,洗涤、干燥、称量、电极增重 0.64 g,甲烧杯中产生的气体标准状况下体积为 mL 。
 2C(g)
2C(g)  H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。
H=" -a" kJ/mol(a>0),在一个有催化剂的固定容积的密闭容器中加入2molA2和1molB2,在500℃是充分反应达到平衡后C的浓度为w mol/L,放出热量b kJ。 pC(g)+ qD(g);根据下图示回答:
pC(g)+ qD(g);根据下图示回答: