题目内容
8.下列叙述正确的是( )| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
分析 A、溶液的体积≠溶剂的体积;
B、根据C=$\frac{n}{V}$分析判断,注意体积指溶液体积不是溶剂体积.
C、根据原溶液是否饱和及是否有氯化钠析出分析判断.
D、.根据稀释后溶质物质的量不变来分析;
解答 解:A、5.85gNaCl晶体的物质的量是0.1mol,将5.85gNaCl晶体溶入100mL水中,导致溶液的体积大于100mL,所以配制溶液的物质的量浓度小于0.1mol/L,故A错误.
B、C=$\frac{n}{V}$=$\frac{\frac{25g}{160g/mol}}{0.1L}$=1.56mol/L,故B错误.
C、wga%的NaCl溶液中溶质质量为wa%,蒸发掉$\frac{w}{2}$g水后,溶质不析出,溶质的质量分数=$\frac{wa%}{w-\frac{w}{2}}$=2a%,故C正确;
D、将1体积cmol/L的硫酸溶质物质的量不变,用4体积水稀释,稀释后溶液的体积不是原来的5倍,故稀释后稀溶液的浓度不是0.2cmol/L,故D错误;
故选C.
点评 本题考查了物质的量浓度的有关问题,难度不大,注意公式C=$\frac{n}{V}$中体积指溶液体积不是溶剂体积.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
19.下列关于能层与能级的说法中正确的是( )
| A. | 1个原子轨道里最多只能容纳2个电子,但自旋方向相同 | |
| B. | 任一能层的能级总是从s能级开始,以f能级收尾,而且能级数等于该能层序数 | |
| C. | 同是s能级,在不同的能层中所能容纳的最多电子数是不相同的 | |
| D. | 钠原子核外共有11种运动方式不同的核外电子 |
3.某有机物是药物生产的中间体,其结构简式如图.下列有关叙述不正确的是( )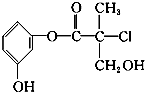

| A. | 该有机物的分子式为C10H11O4Cl | |
| B. | 该有机物与浓溴水可发生取代反应,且与浓硫酸混合共热可发生消去反应 | |
| C. | 1 mol该有机物与足量NaOH溶液反应最多消耗4 mol NaOH | |
| D. | 该有机物经催化氧化后与新制氢氧化铜悬浊液共热生成砖红色沉淀 |
13.用铝箔包裹0.1mol金属钠,用针刺出一些小孔,放入水中,完全反应后,产生的气体的体积为(标准状况)( )
| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
20.黑火药爆炸过程中发生反应的化学方程式为2KNO3+3C+S═K2S+N2↑+3CO2↑.下列说法正确的是( )
| A. | 每生成55 g K2S转移电子数为6.02×1023 | |
| B. | S和KNO3均为还原剂 | |
| C. | 反应过程中氮元素被还原 | |
| D. | CO2为还原产物 |
17.既是分解反应又是氧化还原反应的是( )
| A. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ | B. | 2HI$\frac{\underline{\;高温\;}}{\;}$H2+I2 | ||
| C. | H2O+SO2═H2SO3 | D. | Fe2O2+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2 |
5.从废钒催化剂(主要成分V2O5、VOSO4、K2SO4、SiO2和Fe2O3等)中回收V2O5的一种生产工艺流程示意图如下:
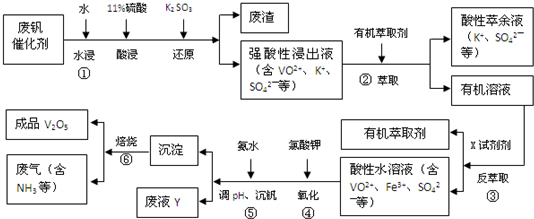
回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4)n(水层)+2n HA(有机层)?2RAn(有机层)+n H2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
试判断在实际生产时,⑤中加入氨水调节溶液的最佳pH为1.7;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3.(已知:25℃时,Ksp(Fe(OH)3)=2.6×10-39.)
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:
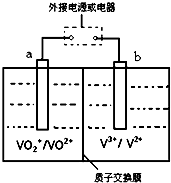
①全矾液流电池的工作原理为:VO2++V2++2H+ $?_{()电}^{()电}$VO2++H2O+V3+(请在可逆符号两侧的括号中填“充”、“放”)此时,b极接直流电源负极.
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O,当转移1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”).

回答下列问题:
(1)①中废渣的主要成分是SiO2.
(2)②、③中的变化过程可简化为(下式中的R表示VO2+或Fe3+,HA表示有机萃取剂的主要成分):
R2(SO4)n(水层)+2n HA(有机层)?2RAn(有机层)+n H2SO4(水层).②中萃取时必须加入适量碱,其原因是加入碱中和产生的酸,平衡右移,提高钒的萃取率;③中反萃取时加入的X试剂是硫酸.
(3)完成④中反应的离子方程式:
1ClO3-+6VO2++6H+═6VO3++1(Cl-)+3(H2O)
(4)25℃时,取样进行实验分析,得到钒沉淀率和溶液pH之间的关系如下表
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
(5)写出废液Y中除H+之外的两种阳离子:Fe3+、VO3+、NH4+、K+(任写两种即可).
(6)生产时,将②中的酸性萃余液循环用于①中的水浸.在整个工艺过程中,可以循环利用的物质还有有机萃取剂、氨水(或氨气).
(7)全矾液流电池是一种新型电能储存和高效转化装置(如图所示,a、b均为惰性电极),已知:V2+为紫色,V3+为绿色,VO2+为蓝色,VO2+为黄色.当充电时,右槽溶液颜色由绿色变为紫色.则:

①全矾液流电池的工作原理为:VO2++V2++2H+ $?_{()电}^{()电}$VO2++H2O+V3+(请在可逆符号两侧的括号中填“充”、“放”)此时,b极接直流电源负极.
②放电过程中,a极的反应式为VO2++2H++e-=VO2++H2O,当转移1.0mol电子时共有1.0mol H+从右槽迁移进左槽(填“左”、“右”).
 ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.