题目内容
13.用铝箔包裹0.1mol金属钠,用针刺出一些小孔,放入水中,完全反应后,产生的气体的体积为(标准状况)( )| A. | 小于1.12L | B. | 1.12L | ||
| C. | 在1.12L和4.48L之间 | D. | 大于4.48L |
分析 Na和水反应:2Na+2H2O=2NaOH+H2↑,计算Na反应生成氢气物质的量,Al与氢氧化钠反应又发生反应:2Al+2H2O+2NaOH=2NaAlO2+3H2↑,故实际得到气体体积大于Na与水反应生成氢气体积,小于上述两反应生成的氢气体积之和.
解答 解:由2Na+2H2O=2NaOH+H2↑,可知生成NaOH为0.1mol,生成氢气为$\frac{0.1mol}{2}$=0.05mol,其体积=0.05mol×22.4L/mol=1.12L,
由2Al+2H2O+2NaOH=2NaAlO2+3H2↑,可知0.1molNaOH完全反应生成氢气为0.1mol×$\frac{3}{2}$=0.15mol,故两反应得到氢气总体积为:(0.05mol+0.15mol)×22.4L/mol=4.48L,
故生成氢气体积1.12L<V(氢气)≤4.48L,
故选:C.
点评 本题考查钠、铝的化学性质及化学方程式的计算,侧重于学生的分析能力和计算能力的考查,难度不大,熟悉发生的化学反应是解答本题的关键.

练习册系列答案
相关题目
3.下列实验操作中错误的是( )
| A. | 蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台 | |
| B. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |
4.某元素R的阴离子Rn-核外共有X个电子,该元素原子的质量数为A,则该元素原子里含有中子数为( )
| A. | A+X-n | B. | A-X-n | C. | A+X+n | D. | A-X+n |
1.葡萄糖是一种单糖的理由是( )
| A. | 它不能发生分解反应 | B. | 不能再水解成更简单的糖 | ||
| C. | 分子中只含一个醛基 | D. | 葡萄糖分子中含碳原子数最少 |
8.下列叙述正确的是( )
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
18.下列离子方程式书写正确的是( )
| A. | 小苏打和盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 三氯化铁溶液中加入铁粉 Fe3++Fe═2Fe2+ | |
| D. | 氢氧化铝溶于强碱:Al(OH)3+OH-═AlO2-+2H2O |
2.设NA为阿伏伽德罗常数的值,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol 甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5mol 1,3-丁二烯分子中含有 数为NA 数为NA | |
| D. | 1mol碳正离子(CH${\;}_{3}^{+}$)所含的电子总数为8NA |
10.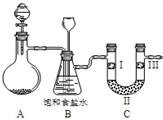 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.
(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
(4)为了进一步比较氧化性强弱,将一定量氯气通入溴化亚铁溶液后,再加入四氯化碳,振荡,静置,整个过程中肯定能观察到的现象是A
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).
 某学习小组围绕氯气设计了系列实验.
某学习小组围绕氯气设计了系列实验.(1)用如图装置A制备氯气.选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:Ca(ClO)2+4HCl(浓)═CaCl2+2Cl2↑+2H2O.实验过程中,使用分液漏斗滴加液体的操作是打开分液漏斗上口活塞(或将漏斗口活塞上的凹槽与瓶口上的小孔对齐),左手顶住漏斗球,右手转动颈部活塞控制加液.
(2)装置B中饱和食盐水的作用是除去氯气中的HCl;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象B中长颈漏斗下端导管中液面会上升,形成水柱.
(3)为检验氯气是否具有漂白性,使氯气依次通过I、Ⅱ、Ⅲ三种物质,物质的顺序正确的是:D.
| A | B | C | D | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
A.水层显棕黄色 B.水层无色 C.四氯化碳层显红棕色 D.四氯化碳层无色
(5)查阅资料后小组发现,氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,排除环境方面的因素,可能的原因是:氯气、浓硝酸、酸性高锰酸钾等氧化性太强,还能继续氧化碘单质
(6)有人提出,工业上为防止污染空气,可用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:HSO3-+Cl2+H2O═SO42-+2Cl-+3H+(或4HSO3-+Cl2═SO42-+2Cl-+3SO2↑+2H2O).判断改用NaHSO3溶液是否可行:否(填“是”或“否”).