题目内容
18. ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.
ClO2气体是一种常用的消毒剂,近几年我国用ClO2代替氯气对饮用水进行消毒.(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,由此说明ClO2具有氧化性.
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:2KClO3+SO2═2ClO2+K2SO4.
(3)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8mg•L-1之间.碘量法可以检测水中ClO2的浓度,步骤如下:
Ⅰ取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝.
Ⅱ加入一定量的Na2S2O3溶液.(已知:2S2O32-+I2═S4O62-+2I-)
Ⅲ加硫酸调节水样pH至1~3.
操作时,不同pH环境中粒子种类如图所示,请回答:
①操作Ⅰ中反应的离子方程式是2ClO2+2I-═2ClO2-+I2.
②确定操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色.
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是ClO2-+4I-+4H+=Cl-+2I2+2H2O.
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是0.675mg•L-1.
分析 (1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低;
(2)Cl元素的化合价由+5价降低为+4价,则S元素的化合价升高,结合电子守恒及原子守恒分析;
(3)①操作I中发生ClO2、I-的氧化还原反应;
②加入一定量的Na2S2O3溶液,由2S2O32-+I2═S4O62-+2I-可知,完全反应时不存在单质碘;
③酸性溶液中发生氧化还原反应生成碘单质;
④根据关系式ClO2~I-~S2O32-先计算出ClO2的物质的量,然后再计算出浓度.
解答 解:(1)ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,Fe、Mn元素的化合价升高,则Cl元素的化合价降低,可说明ClO2具有氧化性,
故答案为:氧化;
(2)Cl元素的化合价由+5价降低为+4价,则S元素的化合价升高,结合电子守恒及原子守恒可知还生成K2SO4,故答案为:K2SO4;
(3)①操作I中发生ClO2、I-的氧化还原反应,其离子反应为2ClO2+2I-═2ClO2-+I2,加入淀粉溶液,溶液变蓝,故答案为:2ClO2+2I-═2ClO2-+I2;
②加入一定量的Na2S2O3溶液,由2S2O32-+I2═S4O62-+2I-可知,完全反应时不存在单质碘,则操作Ⅱ完全反应的现象是蓝色消失,半分钟内不变色,
故答案为:蓝色消失,半分钟内不变色;
③酸性溶液中发生氧化还原反应生成碘单质,离子反应为ClO2-+4I-+4H+=Cl-+2I2+2H2O,故答案为:ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④操作Ⅱ时消耗了1.0×10-3 mol•L-1的Na2S2O3溶液10mL,其物质的量为1.0×10-3 mol/L×0.01L,
ClO2 ~I-~S2O32-
1 1
1.0×10-5mol 1.0×10-3 mol/L×0.01L
m(ClO2)=n(ClO2)×M(ClO2)=1.0×10-5mol×67.5×103mg•mol-1=0.675mg,
由于水样的体积为1.0L,所以 ClO2 的浓度为$\frac{0.675mg}{1L}$=0.675 mg•L-1,
故答案为:0.675.
点评 本题考查物质含量的测定实验,为高频考点,把握发生的氧化还原反应、关系式法的计算为解答的关键,侧重分析与计算能力的综合考查,题目难度不大.

 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案| A. | 氕和氘 | B. | CH3CH3和CH3CH2CH3 | ||
| C. |  和 和 | D. | O2和O3 |
| A. | 天然气、石油、流水、风力、氢气为一级能源 | |
| B. | 研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 | |
| C. | 铝合金的大量使用归功于人们能用焦炭等还原剂从氧化铝中获取铝单质 | |
| D. | 实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、资源的循环利用(Recycle) |
| A. | 蒸发使用的主要仪器是蒸发皿、酒精灯、玻璃棒、带铁圈的铁架台 | |
| B. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 | |
| C. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 | |
| D. | 用规格为10 mL的量筒量取6.20 mL的液体 |
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
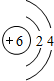
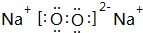 ;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;
;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;