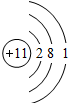题目内容
16.请回答下列问题:25℃时,浓度均为0.10mol•L-1的 ①氨水 ②NH4Cl溶液(1)氨水显碱性的原因(用离子方程式表示)NH3•H2O?NH4++OH-,向氨水中加入NH4Cl固体,氨水的电离程度减小(填“增大”、“减小”或“不变”),原因是增大铵根的浓度,平衡向左移动,溶液的pH将减小(填“增大”、“减小”或“不变”).
(2)NH4Cl溶液显酸性,原因是(用离子方程式表示)NH4++H2O?NH3•H2O+H+,若加入少量的氨水,使溶液中c(NH4+)=c(Cl-),则溶液的pH=7 (填“>”、“<”或“=”).
(3)Mg(OH)2浊液中存在Mg(OH)2的溶解平衡,可表示为(用离子方程式表示)Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),向此浊液中加入浓的NH4Cl溶液,观察到的现象是沉淀溶解,用离子方程式表示产生此现象的过程Mg(OH)2(s)+2NH4+═Mg2++2NH3•H2O.
分析 (1)氨水显碱性,是因为一水合氨能够微弱电离生成氢氧根离子;一水合氨是弱碱,存在电离平衡,增大铵根离子浓度时,平衡逆向移动,溶液碱性减弱;
(2)氯化铵溶液中因为铵根离子的水解,使溶液显酸性,加入氨水导致c(NH4+)=c(Cl-),据电荷守恒分析其pH;
(3)沉淀溶解平衡方程式书写时注意标明各物质的状态,一水合氨比氢氧化镁更难电离,所以向Mg(OH)2浊液中加入浓的NH4Cl溶液,沉淀溶解.
解答 解:(1)氨水显碱性,是因为一水合氨能够微弱电离生成氢氧根离子,电离方程式为NH3•H2O?NH4++OH-,一水合氨是弱碱,存在电离平衡,增大铵根离子浓度时,平衡逆向移动,氨水的电离程度减小,溶液碱性减弱,pH减小;故答案为:NH3•H2O?NH4++OH-;减小;增大铵根的浓度,平衡向左移动;减小;
(2)氯化铵溶液中因为铵根离子的水解,使溶液显酸性,铵根水解的离子方程式为NH4++H2O?NH3•H2O+H+,加入氨水导致c(NH4+)=c(Cl-),据电荷守恒则有氢离子浓度与氢氧根离子浓度相等,都是10-7mol/L,pH=7,故答案为:酸性;NH4++H2O?NH3•H2O+H+;=;
(3)Mg(OH)2的溶解平衡方程式为Mg(OH)2(s)?Mg2+(aq)+2OH-(aq),向Mg(OH)2浊液中加入浓的NH4Cl溶液,一水合氨比氢氧化镁更难电离,所以铵根离子会结合氢氧根离子生成一水合氨,促使氢氧化镁逐渐溶解,离子方程式为 Mg(OH)2(s)+2 NH4+═Mg2++2NH3•H2O,
故答案为:Mg(OH)2(s)?Mg2+(aq)+2OH-(aq);沉淀溶解; Mg(OH)2(s)+2 NH4+═Mg2++2NH3•H2O.
点评 本题考查了弱电解质电离方程式书写、电离平衡的移动、盐类水解、沉淀转化,题目难度不大,注意沉淀溶解平衡方程式书写与弱电解质电离平衡方程式书写的区别.

 优加精卷系列答案
优加精卷系列答案| A. | A+X-n | B. | A-X-n | C. | A+X+n | D. | A-X+n |
| A. | Cl2通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 硫酸铝溶液与过量氨水反应:Al3++3NH3•H2O═3NH${\;}_{4}^{+}$+Al(OH)3↓ | |
| C. | 实验室用石灰石和盐酸反应制取 CO2:CO${\;}_{3}^{2-}$+2H+═CO2+H2O | |
| D. | 向Na2SO3溶液中加入稀硝酸:SO${\;}_{3}^{2-}$+2H+═SO2↑+H2O |
| A. | 它不能发生分解反应 | B. | 不能再水解成更简单的糖 | ||
| C. | 分子中只含一个醛基 | D. | 葡萄糖分子中含碳原子数最少 |
| A. | 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液 | |
| B. | 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L | |
| C. | 将wg a%的NaCl溶液蒸发掉$\frac{w}{2}$g水,得到2a%的NaCl溶液 | |
| D. | 将1体积c1mol/L的硫酸用4体积水稀释,稀溶液的浓度为0.2c1mol/L |
| A. | 核电荷为12的原子 | B. | 质子数为8的原子 | ||
| C. | K层为最外层时有2个电子的原子 | D. | 核电荷数为9的原子 |
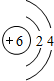
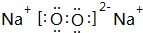 ;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;
;存在的化学键类型有离子键、共价键,其与甲反应的化学方程式是2Na2O2+2CO2=2Na2CO3+O2;