题目内容
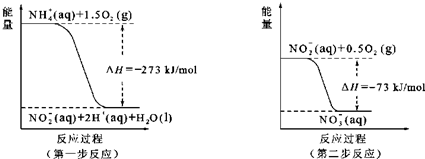
14.“西气东输”是西部开发的重点工程,“气”指天然气,其主要成分为甲烷.已知1mol CO完全燃烧放出的热量为283kJ,1mol CH4完全燃烧生成CO2和液态水 放出的热量为890kJ.请回答:(1)CO的燃烧热△H为-283 kJ/mol.
(2)表示CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol.
(3)若1mol C 完全燃烧放出的热量为394kJ,则1mol C 不完全燃烧生成CO 放出的热量为111kJ.
分析 (1)因为1mol CO完全燃烧放出的热量为283kJ,所以CO的燃烧热△H为-283 kJ/mol;
(2)1mol CH4完全燃烧生成CO2和液态水 放出的热量为890kJ,所以CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890 kJ/mol;
(3)1mol CO完全燃烧放出的热量为283kJ,所以CO的燃烧热△H为-283 kJ/mol,所以热化学方程式为:CO(g))+$\frac{1}{2}$O2(g)=CO2(g);△H=-283 kJ/mol①;而1mol C 完全燃烧放出的热量为394kJ,所以热化学方程式为:C(s))+O2(g)=CO2(g);△H=-394 kJ/mol②;由②-①得:C(s))+$\frac{1}{2}$O2(g)=CO(g);△H=-111 kJ/mol.
解答 解:(1)因为1mol CO完全燃烧放出的热量为283kJ,所以CO的燃烧热△H为-283 kJ/mol,故答案为:-283 kJ/mol;
(2)1mol CH4完全燃烧生成CO2和液态水 放出的热量为890kJ,所以CH4的燃烧热的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol;故答案为:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890 kJ/mol;
(3)1mol CO完全燃烧放出的热量为283kJ,所以CO的燃烧热△H为-283 kJ/mol,所以热化学方程式为:CO(g))+$\frac{1}{2}$O2(g)=CO2(g);△H=-283 kJ/mol①;而1mol C 完全燃烧放出的热量为394kJ,所以热化学方程式为:C(s))+O2(g)=CO2(g);△H=-394 kJ/mol②;由②-①得:C(s))+$\frac{1}{2}$O2(g)=CO(g);△H=-111 kJ/mol,故答案为:111.
点评 本题考查反应热的有关计算,涉及反应热的计算、热化学反应方程式的书写和盖斯定律,难度较大.

 名校课堂系列答案
名校课堂系列答案| A. | 它是高分子化合物 | |
| B. | 它在一定条件下能水解,最终生成葡萄糖 | |
| C. | 是天然蛋白质,仅由C、H、O、N四种元素组成 | |
| D. | 是一种特殊的蛋白质,滴加浓HNO3不发生颜色反应,灼烧时没有任何气味 |
| A. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| B. | 在101 kPa时,1 mol碳燃烧所放出的热量为碳的燃烧热 | |
| C. | 物质燃烧都需要氧气 | |
| D. | 物质燃烧放出热最的多少与外界条件有关 |
| A. | 雷雨时,可增加土壤中硝酸盐类氮肥的含量 | |
| B. | 许多领域中用液氮制得低温环境 | |
| C. | 造成光化学烟雾的罪魁祸首是SO2 | |
| D. | 正常雨水因溶有CO2,其pH约为5.6,而酸雨的pH小于5.6 |

| A. | 它可以使酸性KMnO4溶液褪色 | |
| B. | 它可以与银氨溶液反应 | |
| C. | 它可以使溴水褪色 | |
| D. | 它可被催化加氢,最后产物是C10H20O |

| 丙分子式 | C16H14O2 |
| 部分性质 | 能使Br2/CCl4褪色 |
| 能在稀H2SO4中水解 |
(2)由甲可以制取高聚物K,请写出该反应的方程式
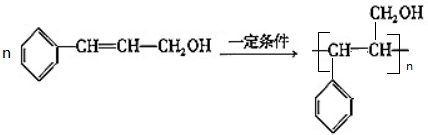
(3)由甲转化为乙需经下列过程(已略去各步反应的无关产物,下同):
甲$→_{Ⅰ}^{一定条件}$
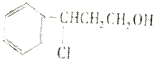 $→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙
$→_{△}^{O_{2}/Cu}$Y$→_{Ⅱ}^{一定条件}$乙其中反应Ⅰ的反应类型为加成反应,反应Ⅱ的化学方程式为
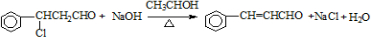 (注明反应条件).
(注明反应条件).(4)已知:RCH=CHR′$→_{ii.Zn/H_{2}O}^{i.O_{3}}$RCHO+R′CHO;2HCHO$→_{ii.H+}^{i.浓NaOH}$HCOOH+CH3OH
由乙制丙的一种合成路线图如图2(A~F均为有机物,图中Mr表示相对分子质量):
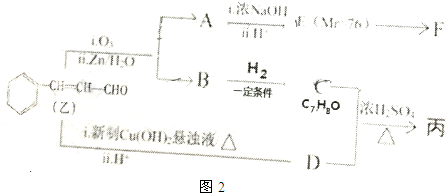
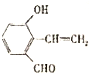
①C与D发生酯化反应生成丙,则丙的结构简式为
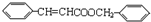 .
.②下列物质不能与C反应的是bc(选填序号)
a.金属钠 b.氢氧化钠 c.Na2CO3溶液 d.乙酸
③F是由两分子E生成的六元环,写出F的结构简式
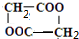 .
.④同时符合以下条件的D的同分异构体有10种,
a.苯环上有三个取代基 b.能发生银镜反应 c.能与Br2的CCl4溶液发生加成反应 d.属于酚类
写出其中任意一种的结构简式
 .
.