题目内容
8.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
分析 根据晶体的类型和所含化学键的类型分析,离子化合物含有离子键,可能含有共价键,共价化合物只含共价键,双原子分子或多原子分子含有共价键.
解答 解:A、固体CO2是分子晶体,二氧化硅是原子晶体,二者晶体类型不同,二氧化硅、二氧化碳都只含共价键,故A错误;
B、Na2O2是离子晶体,固体H2O2是分子晶体,二者晶体类型不同,故B错误;
C、NaCl是离子晶体,NaCl中只含离子键,固体HCl分子晶体,HCl中只含共价键,二者化学键类型和晶体类型均不相同,故C错误;
D、固体CCl4和CS2都是分子晶体,CCl4和CS2都只含共价键,二者化学键类型相同、晶体类型也相同,故D正确;
故选:D.
点评 本题考查了化学键类型和晶体类型的关系.判断依据为:离子晶体中阴阳离子以离子键结合,原子晶体中原子以共价键结合,分子晶体中分子之间以分子间作用力结合,分子内部存在化学键.

练习册系列答案
相关题目
18.下列关于有机物性质的说法正确的是( )
| A. | 乙烯和甲烷在一定条件下都可以与氯气反应 | |
| B. | 乙烯和聚乙烯都能使溴的四氯化碳溶液褪色 | |
| C. | 乙烯和苯都能使酸性高锰酸钾溶液褪色 | |
| D. | 乙烯和乙烷都可以与氢气发生加成反应 |
3.下列分子中所有原子都满足最外层8电子结构的是( )
| A. | XeF4 | B. | SF6 | C. | CCl4 | D. | BF3 |
13.4p轨道填充一半电子的元素,其原子序数是( )
| A. | 15 | B. | 33 | C. | 35 | D. | 20 |
20.下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是( )
| A. | NH3 平面三角形 sp3杂化 | B. | CCl4 正四面体 sp3杂化 | ||
| C. | H2O V形 sp2杂化 | D. | CO32- 三角锥形 sp3杂化 |
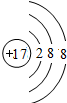 、
、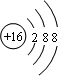 ;
;
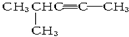 分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.
分子式为C6H10,以系统命名法命名的名称是4-甲基-2-戊炔,1mol该烃完全燃烧耗O28.5 mol.