题目内容
20.下列分子中,各分子的空间构型和中心原子的杂化方式均正确的是( )| A. | NH3 平面三角形 sp3杂化 | B. | CCl4 正四面体 sp3杂化 | ||
| C. | H2O V形 sp2杂化 | D. | CO32- 三角锥形 sp3杂化 |
分析 根据价层电子对互斥理论确定分子空间构型及中心原子杂化方式,价层电子对个数=配原子个数+孤电子对个数.
解答 解:A、NH3中心原子的价层电子对数=3+$\frac{1}{2}$(5-3×1)=4,杂化方式为sp3,含有一个孤电子对,分子的立体构型为三角锥形,故A错误;
B、CCl4中心原子的价层电子对数=4+$\frac{1}{2}$(4-4×1)=4,杂化方式为sp3,没有孤电子对,分子的立体构型为正四面体,故B正确;
C、H2O中心原子的价层电子对数=2+$\frac{1}{2}$(6-2×1)=4,杂化方式为sp3,含有两个孤电子对,分子的立体构型为V形,故C错误;
D、CO32- 中心原子的价层电子对数=3+$\frac{1}{2}$(4+2-3×2)=3,杂化方式为sp2,没有孤电子对,分子的立体构型为平面三角形,故D错误;
故选B.
点评 本题考查了微粒空间构型及原子杂化方式,根据价层电子对互斥理论来分析解答即可,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握,题目难度中等.

练习册系列答案
相关题目
10.加入稀盐酸后,溶液中下列离子数目不减少的是( )
| A. | CO32- | B. | SO42- | C. | Ag+ | D. | SO32- |
11.可用于区别苯、甲苯、苯酚、四氯化碳四种无色液体,所选试剂正确的一组为( )
| A. | 氯化铁溶液、溴水 | B. | NaOH溶液、溴水 | ||
| C. | 高锰酸钾溶液、溴水 | D. | NaHCO3溶液、溴水 |
8.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
15.下列分子的价电子模型(VSEPR模型)和分子的模型相同的是( )
| A. | NH3 | B. | CO2 | C. | H2O | D. | SO2 |
5.下表是元素周期表的一部分( 注意:用元素符号或化学式填空)
(1)C的离子的结构示意图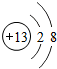 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
(2)H元素的单质的电子式 ;
;
(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程
(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
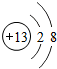 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3(2)H元素的单质的电子式
 ;
;(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程

(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.