题目内容
17.A、B两元素为同一周期ⅡA族和ⅢA族元素,若A元素的原子序数为x,则B元素的原子序数可能为( )①x+1 ②x+8 ③x+11 ④x+18 ⑤x+25 ⑥x+32.
| A. | ①②③④ | B. | ①③⑥ | C. | ①③⑤ | D. | ②④⑥ |
分析 元素周期表中,从第四周期开始出现过渡元素,第ⅠA、ⅡA之后是第ⅢB,在第六、七周期中的过渡元素又出现镧系和锕系,根据周期表的结构来回答.
解答 解:因为是同一周期的IIA族,即同一横行往右一个主族,在第二、三周期原子序数增加1,因而可以x+1;
又因为IIA族与IIIA族元素在第四周期起有过渡元素,因而又可以为x+11;
在第六、七周期的过渡元素中又出现镧系和锕系,因而又可以为x+25.
故选C.
点评 本题考查学生元素周期表的结构知识,注意把握周期表中的列和族的关系及副族元素的位置,题目难度不大.

练习册系列答案
相关题目
7. 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
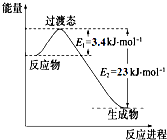
(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
①实验2条件下平衡常数K=$\frac{1}{6}$.
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.
 研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.
研究表明丰富的CO2完全可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)到本世纪中叶将枯竭的危机,同时又可缓解由CO2累积所产生的温室效应,实现CO2的良性循环.(1)目前工业上有一种方法是用CO2和H2在230℃催化剂条件下转化生成甲醇蒸气和水蒸气.如图表示恒压容器中0.5molCO2和1.5molH2转化率达80%时的能量变化示意图.能判断该反应达到化学平衡状态的依据是bd.(填字母)
a.容器中压强不变 b.H2的体积分数不变
c.c(H2)=3c(CH3OH) d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂.
(2)将不同量的CO(g)和H2O分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)?CO2(g)+H2(g),得到如下三组数据:
| 实验组 | 温度 ℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min[ | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
②实验3中,若平衡时,CO的转化率大于水蒸气,则a/b的值0<$\frac{a}{b}$<1(填具体值或取值范围).
③实验4,若900℃时,在此容器中加入CO、H2O、CO2、H2均为1 mol时,则此时v(正)<v(逆)(填“<”“>”或“=”).
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-1275.6kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H=-566.0kJ/mol
③H2O(g)=H2O(l)△H=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=-442.8kJ•mol-1.
(4)已知草酸是一种二元弱酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L H2C2O4溶液中滴加10mL0.01mol/L NaOH溶液,比较溶液中各种离子浓度的大小关系c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池,该电池的负极反应式为CH3OCH3-12e-+16OH-=2CO32-+11H2O.
8.下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
| A. | CO2和SiO2 | B. | Na2O2和H2O2 | C. | NaCl和HCl | D. | CCl4和CS2 |
5.下表是元素周期表的一部分( 注意:用元素符号或化学式填空)
(1)C的离子的结构示意图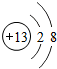 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
(2)H元素的单质的电子式 ;
;
(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程
(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
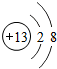 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3(2)H元素的单质的电子式
 ;
;(3)A-H八种元素中
(a)原子半径最大的元素是K
(b)单质的还原性最强的元素是K
(c)最高价氧化物对应水化物酸性最强的是HClO4
(d)最高价氧化物对应水化物碱性最强的是KOH.
(4)电子式表示AE2的形成过程

(5)B与C的最高价氧化物对应水化物反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O.
6.有关化学用语正确的是( )
| A. | 乙烯的最简式C2H4 | B. | 丙酮的分子式C3H6O | ||
| C. | 四氯化碳的电子式为: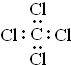 | D. | 乙醇的结构简式C2H6O |
7.下列过程不能同时生成两种盐的是( )
| A. | FeCl3溶液溶解铜 | B. | NaOH溶液吸收Cl2 | C. | Fe3O4与盐酸反应 | D. | CuCl2与Zn反应 |