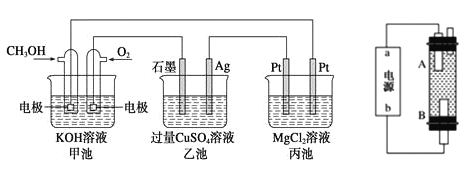
题目内容
【题目】1.28g铜投入一定量的浓硝酸中,铜完全溶解,生成气体颜色越来越浅,共收集到VmL气体(标准状况),将盛有此气体的容器倒扣在水中,通入氧气恰好使气体完全溶解在水中,则需要标准状况下的氧气体积为( )
A. 504mLB. 336mLC. 224mLD. 168mL
【答案】C
【解析】
1.28g铜的物质的量为![]() =0.02mol,Cu与硝酸反应生成硝酸铜与氮的氧化物,而氮的氧化物倒扣在水中,通入氧气,恰好使气体完全溶于水中,又生成硝酸,纵观整个反应过程可知,铜提供的电子等于通入的氧气获得的电子,故通入氧气的物质的量为
=0.02mol,Cu与硝酸反应生成硝酸铜与氮的氧化物,而氮的氧化物倒扣在水中,通入氧气,恰好使气体完全溶于水中,又生成硝酸,纵观整个反应过程可知,铜提供的电子等于通入的氧气获得的电子,故通入氧气的物质的量为![]() =0.01mol,通入氧气的体积=0.01mol×22.4L/mol=0.224L=224mL;
=0.01mol,通入氧气的体积=0.01mol×22.4L/mol=0.224L=224mL;
故选C。

练习册系列答案
相关题目
【题目】下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
(1)f和d形成的物质的化学式为____。
(2)ac2分子的电子式为___。
(3)g单质溶于NaOH溶液的离子方程式为____。
(4)e单质在氧气中点燃得到淡黄色固体
①淡黄色固体的电子式为___,
②该物质存在的化学键的类型有___。
(5)为了比较该部分周素表中非金属元素的非金属性强弱,以下说法不正确的是___。
a.可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性
b.已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,则非金属j>i
c.向i的气态氢化物的水溶液中加j单质,发现溶液变浑浊,则i的非金属性弱于j