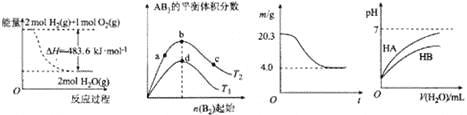
题目内容
【题目】为了证明NH3·H2O是弱电解质,甲、乙、丙三人分别选用下列试剂进行实验。0.010 mol·L-1氨水、0.1 mol·L-1NH4Cl溶液、NH4Cl晶体、酚酞溶液、pH试纸、蒸馏水。
①甲用pH试纸测出0.010 mol·L-1氨水的pH为10,则认定NH3·H2O是弱电解质,你认为这一方法________(填“正确”或“不正确”),并说明理由:_______________________。
②乙取出10 mL 0.010 mol·L-1氨水,用pH试纸测其pH=a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测其pH=b,若要确认NH3·H2O是弱电解质,则a、b值应满足的关系是________。
③丙取出10 mL 0.010 mol·L-1氨水,滴入2滴酚酞溶液,显粉红色,再加入少量NH4Cl晶体,颜色变______(填“深”或“浅”)。你认为证明氨水是弱碱的原因是_____________。
④请你根据所提供的试剂,再提出一个合理简便的方案证明NH3·H2O是弱电解质:_________。
(2)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
【答案】正确 若是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12 a-2<b<a 浅 0.010 mol·L-1氨水(滴有酚酞溶液)中加入氯化铵晶体后c(NH4+)增大,使NH3·H2O的电离平衡NH3·H2O![]() NH4++OH-逆向移动,从而使溶液的pH降低。可证明NH3·H2O是弱电解质 取一张pH试纸,用玻璃棒蘸取0.01 mol·L-1NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可) 中 10-9/(a-0.01)
NH4++OH-逆向移动,从而使溶液的pH降低。可证明NH3·H2O是弱电解质 取一张pH试纸,用玻璃棒蘸取0.01 mol·L-1NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7(方案合理即可) 中 10-9/(a-0.01)
【解析】
(1)①根据一定物质的量浓度的溶液的pH大小,确定电解质的电离程度,进而确定强弱电解质;
②利用假设法分析,假设是强碱,稀释100倍后,溶液的pH减小2个单位,如果是弱碱,稀释100倍后,溶液的pH变化量小于2个单位;
③如果氨水是弱碱,则存在电离平衡,加入含有相同离子的盐能改变平衡的移动,则溶液的颜色发生变化,据此判断;
④根据氯化铵溶液的酸碱性确定一水合氨电解质的强弱;
(2)根据电荷守恒、物料守恒结合电离平衡常数的计算式解答。
(1)①如果一水合氨是强电解质,则0.010 mol·L-1氨水中c(OH-)应为0.010 mol·L-1,pH=12,实际上溶液的pH=10<12,所以NH3·H2O是弱电解质;
②若是强碱,稀释100倍,pH减小2个单位,由于是弱碱,稀释的过程中,会部分电离,即c(OH-)变化的幅度变小,pH减小幅度小于2个单位,则有a-2<b,且b<a,即a-2<b<a;
③向氨水中加入氯化铵晶体后c(NH4+)增大,使NH3·H2O的电离平衡NH3·H2O![]() NH4++OH-逆向移动,从而使溶液的pH降低,溶液的碱性减弱,则溶液的颜色变浅,可证明NH3·H2O是弱电解质;
NH4++OH-逆向移动,从而使溶液的pH降低,溶液的碱性减弱,则溶液的颜色变浅,可证明NH3·H2O是弱电解质;
④根据盐类水解原理可知如果一水合氨是弱电解质,则氯化铵会水解,溶液显酸性,则其实验方案为取一张pH试纸,用玻璃棒蘸取0.1 mol·L-1NH4Cl溶液,滴在pH试纸上,显色后跟标准比色卡比较测出pH,pH<7即可证明。
(2)在25℃下,平衡时溶液中c(NH4+)=c(Cl-)=0.005mol/L,根据物料守恒得c(NH3·H2O)=(0.5a-0.005)mol/L,根据电荷守恒得c(H+)=c(OH-)=10-7mol/L,溶液呈中性,NH3·H2O的电离常数Kb=[c(NH4+)·c(OH-)]/c(NH3·H2O)=10-9/(a-0.01)。

【题目】下表为元素周期表的一部分,根据表中所列出的元素回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
2 | a | b | c | d | |||
3 | e | f | g | h | i | j |
(1)f和d形成的物质的化学式为____。
(2)ac2分子的电子式为___。
(3)g单质溶于NaOH溶液的离子方程式为____。
(4)e单质在氧气中点燃得到淡黄色固体
①淡黄色固体的电子式为___,
②该物质存在的化学键的类型有___。
(5)为了比较该部分周素表中非金属元素的非金属性强弱,以下说法不正确的是___。
a.可以利用这些元素的最高价氧化物对应水化物的酸性比较这些元素的非金属性
b.已知j的气态氢化物水溶液的酸性比i的气态氢化物的水溶液酸性强,则非金属j>i
c.向i的气态氢化物的水溶液中加j单质,发现溶液变浑浊,则i的非金属性弱于j