题目内容
7.相同状况下,4组混合气体:①体积比为3:1的NH3和N2②体积比为1:1的NO和NO2③体积比为1:1的NO2和O2④体积比为4:1的NO2和O2分别置于完全相同的试管里并倒置于水槽中,充分反应后液面上升的高度分别为h1、h2、h3、h4,则下列关系正确的( )| A. | h1>h2>h3>h4 | B. | h4>h3>h2>h1 | C. | h4>h1>h3>h2 | D. | h2>h3>h1>h4 |
分析 ①体积比为3:1的NH3和N2中只有氨气能完全溶于水;
②体积比为1:1的NO和NO2中只有3NO2+H2O═2HNO3+NO,NO不溶于水;
③体积比为1:1的NO2和O2中发生4NO2+O2+2H2O═4HNO3;
④体积比为4:1的NO2和O2中发生4NO2+O2+2H2O═4HNO3.
解答 解:设完全相同的试管的体积为V,充分反应后,液面上升的高度取决于剩余气体的体积,剩余气体越多,液面高度越低,
①体积比为3:1的NH3和N2中只有氨气能完全溶于水,氮气不溶于水,则液面高度为$\frac{3}{4}$V=h1;
②体积比为1:1的NO和NO2中,由3NO2+H2O═2HNO3+NO可知,NO不溶于水,则液面高度为$\frac{1}{3}$V=h2;
③体积比为1:1的NO2和O2中由4NO2+O2+2H2O═4HNO3可知,则液面高度为$\frac{5}{8}$V=h3;
④体积比为4:1的NO2和O2中发生4NO2+O2+2H2O═4HNO3无气体剩余,液体充满试管,液面高度为V,
显然h4>h1>h3>h2,
故选C.
点评 本题考查氨气、氮的氧化物的性质及计算,为高频考点,把握发生的反应及液面与剩余气体体积的关系是解答本题的关键,题目难度不大.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案
相关题目
18.下列除杂方法错误的是( )
| A. | NO中含有NO2,用水洗涤后再干燥 | |
| B. | CO2中含有SO2,通入饱和NaHCO3溶液后干燥 | |
| C. | NH3中含有H2O,用CaCl2进行干燥 | |
| D. | SO2中含有HCl,通入饱和NaHSO3溶液后干燥 |
12.下列实验中,为实现实验目的而必须除杂的是( )
| 实验 | 除杂试剂 | 实验目的 | |
| ① | 电石与水反应 | CuSO4溶液 | 用KMnO4酸性溶液检验乙炔的还原性 |
| ② | CH3CH2Br与NaOH溶液共热 | HNO3溶液 | 用AgNO3溶液检验CH3CH2Br中的Br |
| ③ | 淀粉与稀H2SO4水浴共热 | NaOH溶液 | 用银氨溶液检验水解产物的还原性 |
| ④ | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | 用Br2的CCl4溶液证明该反应为消去反应 |
| A. | ①②③④ | B. | 只有①②④ | C. | 只有②③④ | D. | 只有①②③ |
16.已知aq表示溶液状态.
①H+(aq)+OH-(aq)→H2O(l)+a kJ
②NH4+(aq)+H2O(l)H+(aq)+NH3•H2O(aq)+b kJ
③HAc(aq)+OH-(aq)→Ac-(aq)+H2O(l)+c kJ
则a、b、c的大小关系为( )
①H+(aq)+OH-(aq)→H2O(l)+a kJ
②NH4+(aq)+H2O(l)H+(aq)+NH3•H2O(aq)+b kJ
③HAc(aq)+OH-(aq)→Ac-(aq)+H2O(l)+c kJ
则a、b、c的大小关系为( )
| A. | a>c>b | B. | a=b=c | C. | a=c>b | D. | a>c=b |
17.下列有关有机物的叙述不正确的是( )
| A. | 甲苯的一氯代物有4中,甲苯与氢气完全加成后产物的一氯代物有5种 | |
| B. | 糖类、油脂、蛋白质在一定条件下均可以水解 | |
| C. | 乙醇和葡萄糖均能发生酯化反应 | |
| D. | 漂粉精和医用酒精均可用作消毒剂 |
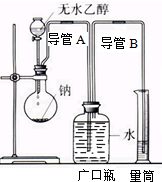 为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题:
为了确定乙醇分子的结构简式CH3-O-CH3还是CH3CH2OH,实验室利用如图所示的实验装置,测定乙醇与钠反应(△H<0)生成氢气的体积,并据此计算乙醇分子中能与金属钠反应的氢原子的数目,试回答下列问题: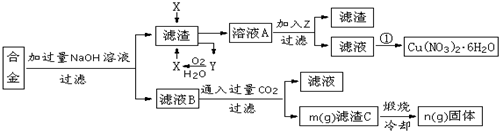
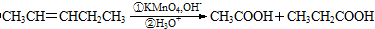
 .
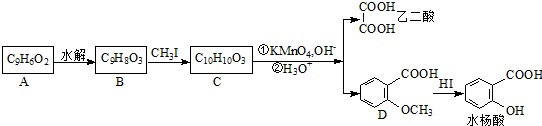
.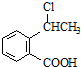 可以最终合成芳香内酯A,其中前两步的反应是
可以最终合成芳香内酯A,其中前两步的反应是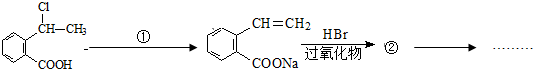
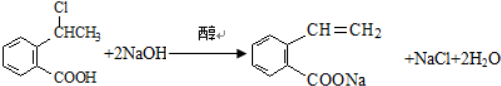 ,产物②的结构简式是
,产物②的结构简式是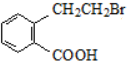 .
.