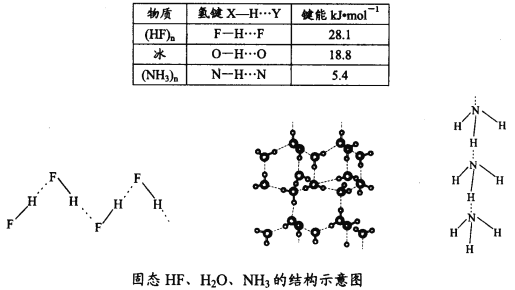
题目内容
【题目】(1)某科研小组研究:在恒温、恒容(容器容积为2L,)下N2(g)+3H2(g)![]() 2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
2NH3(g)反应的变化。初始条件n (H2)= 3mol 、n (N2)=1mol,反应达到平衡时H2的转化率为60%,NH3的体积分数约为43%
①此条件下反应的平衡常数K= 。
②若初始条件n (NH3)= 2mol,反应达到平衡时NH3的转化率为 ,
③若初始条件n (H2)= 6mol 、n (N2) =2mol,反应达到平衡时NH3的体积分数 43%,此时移除0.5 mol NH3 ,再次达到平衡时NH3的体积分数 43% (填 “>、<、=”)
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g)![]() 4NO2(g)+O2(g),ΔH>0
4NO2(g)+O2(g),ΔH>0
①下表为该反应在T1温度下的部分实验数据
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的平均生成速率为 。
②现以NO2、O2、N2O5、熔融盐NaNO3组成的燃料电池,采用电解法制备N2O5,装置如图所示。
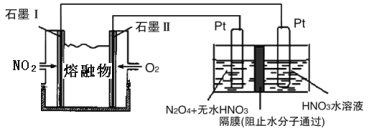
写出石墨I电极上发生反应的电极反应式 。
在电解池中生成N2O5的电极反应式为 。
【答案】(1)①K=8.3 (25/3)。②转化率为40%,③ > , > ;
(2)①0.00592 molL-1s-1。②石墨I电极反应式NO2 + NO3— - e—=N2O5
【解析】
试题分析:(1)①据H2的转化率可求得反应的H2 3mol×60%=1.8mol,浓度为0.9mol/L,则有
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前(mol/L) 0.5 1.5 0
反应了(mol/L) 0.3 0.9 0.6
平衡后(mol/L) 0.2 0.6 0.6
所以:K=![]() =8.3,故答案为:8.3;
=8.3,故答案为:8.3;
②相同条件下,初始时加入n(H2)=3mol、n(N2)=1mol和加入n(NH3)=2mol,按等效平衡理论,达到平衡状态时,各物质的组成完全相同,
则有 N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前(mol/L) 0 0 1
反应了(mol/L) 0.2 0.6 0.4
平衡后(mol/L) 0.2 0.6 0.6
α(NH3)=![]() ×100%=40%,故答案为:40%;
×100%=40%,故答案为:40%;
③因为体积为2L不变,增大反应物的量,相当于加压,平衡正向移动,NH3的体积分数比原平衡大;取出0.5molNH3等于少加了0.25molN2和0.75molH2,但相对于原平衡,还是增大反应物的量,平衡正向移动,NH3的体积分数还是比原平衡大,故答案为:>;>;
(2)①500s内,△c(N2O5)=(5.00-3.52)molL-1=1.48molL-1,则△c(NO2)=![]() ×△c(N2O5)=2×1.48molL-1 =2.96molL-1,v(NO2)=
×△c(N2O5)=2×1.48molL-1 =2.96molL-1,v(NO2)=![]() =5.92×10-3mol/(Ls),故答案为:5.92×10-3mol/(Ls);
=5.92×10-3mol/(Ls),故答案为:5.92×10-3mol/(Ls);
②由4NO2(g)+O2(g)=2N2O5(g)可知,NO2被氧化,因此石墨Ⅰ作为负极,电极方程式为NO2+NO3--e-═N2O5,石墨Ⅱ通入氧气,发生还原反应,为原电池的正极,电极方程式为O2+2N2O5+4e-═4NO3-,左侧Pt为阳极,N2O4→N2O5,氮元素化合价升高,发生氧化反应,阳极电极反应式为N2O4+2HNO3-2e-=2N2O5+2H+,阴极发生2H++2e-=H2↑的反应,因此应该在左侧生成N2O5,即在阳极区域生成,故答案为:NO2+NO3--e-═N2O5;N2O4+2HNO3-2e-=2N2O5+2H+。

【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:
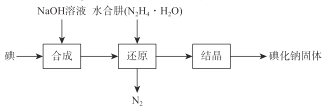
已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。