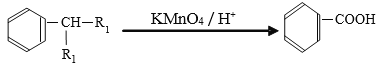题目内容
【题目】X、Y、Z、W 四种短周期元素在周期表中位于连续的四个主族,相对位置如图所示。Z元
素原子核外K层与M层电子数相等。下列说法正确的是
![]()
A. 原子半径由小到大的顺序为Y<X<W<Z
B. Y的单质和Z的单质能够发生反应
C. X的单质都是熔点高、硬度大的物质
D. 工业上利用电解Z、W的熔融氯化物的方法制备对应的单质
【答案】AB
【解析】试题分析:根据Z元素原子核外K层与M层电子数相等,则Z为Mg,W为Al,X为C,Y为N。原子半径:Mg>Al>C>N,A项正确;N2和Mg能够发生反应生成Mg3N2,B项正确;X为碳元素,它有多种同素异形体,金刚石硬度大、熔点高,但石墨硬度小,C项错误;工业上电解熔融的MgCl2制备Mg,电解熔融的Al2O3制备Al,D项错误。

【题目】碘化钠在医药中用作甲状腺肿瘤防治剂、祛痰剂和利尿剂,也用作食品添加剂、感光剂等。 工业上用NaOH溶液、水合肼制取碘化钠固体,其制备流程图如下:

已知:N2H4·H2O在100℃以上分解。
(1)已知,在合成过程的反应产物中含有NaIO3,则在合成过程中消耗了3 mol I2,所生成 NaIO3的物质的量为 mol。
(2)写出还原过程中的离子方程式 ;在还原过程中,为了加快反应,可采取可提高反应温度,但温度不得超过 ℃;请选择下列试剂检测所得碘化钠固体中是否含有NaIO3杂质 (选填字母)。
A.FeCl2溶液 B.冰醋酸
C.KI溶液 D.淀粉溶液
(3)测定产品中NaI含量的实验步骤如下:
a.称取4.000g 样品、溶解,在250mL 容量瓶中定容;
b.量取25.00ml 待测液于锥形瓶中,然后加入足量的FeCl3溶液,充分反应后,再加入A溶液作指示剂;
c.用 0.1000mol·L -1 的Na2S2O3,溶液进行滴定至终点(发生反应的方程式为:
2Na2S2O3 +I2===Na2S4O2 +2NaI),重复测定2次,所得的相关数据如下表:
测定 序号 | 待测液体积/ mL | 标准液滴定管起点读数/ mL | 标准液滴定管终点读数/ mL |
1 | 25.00 | 0.06 | 24.04 |
2 | 25.00 | 0.02 | 24.02 |
3 | 25.00 | 0.12 | 24.14 |
①操作b中,加入足量的FeCl3溶液时所发生的离子方程式为 。
②加入A物质为 (填名称);滴定终点观察到的现象为 。
③计算该样品中NaI的含量为 。
(只写出有具体数值的表达式即可)
(4)碘化钠固体的保存方法是 。