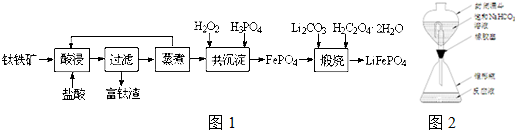
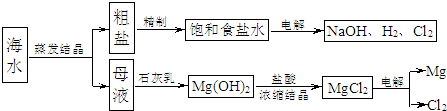
题目内容
16.浓盐酸可以与MnO2反应制取氯气(Cl2):4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.8.7g MnO2与足量的200mL 10mol•L-1浓盐酸反应,可制的标准状况下的氯气多少升?假设溶液的体积没有变化,反应后剩余的溶液中Cl-的物质的量浓度是多少?分析 根据n=$\frac{m}{M}$计算8.7g MnO2的物质的量,根据方程式计算生成氯气物质的量,再根据V=nVm计算氯气体积;根据氯原子守恒计算溶液中Cl-的物质的量浓度.
解答 解:8.7g MnO2的物质的量为$\frac{8.7g}{87g/mol}$=0.1mol,
设生成氯气物质的量为x,则:
4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
1mol 1mol
0.1mol x
故x=$\frac{0.1mol×1mol}{1mol}$=0.1mol
则生成氯气体积为0.1mol×22.4L/mol=2.24;
根据氯原子守恒,可知溶液中n(Cl-)=0.2L×10mol/L-0.1mol×2=1.8mol,则反应后剩余的溶液中Cl-的物质的量浓度为$\frac{1.8mol}{0.2L}$=9mol/L,
答:标准状况下得到氯气2.24升,反应后剩余的溶液中Cl-的物质的量浓度是9mol/L.
点评 本题考查根据方程式的计算,比较基础,旨在考查学生对基础知识的理解掌握.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.核电荷数分别是16和4的元素原子相比较,前者的下列数据是后者4倍的是( )
①质子数 ②最外层电子数 ③电子层数 ④电子总数.
①质子数 ②最外层电子数 ③电子层数 ④电子总数.
| A. | ①② | B. | ①④ | C. | ②③ | D. | ③④ |
4.如图为元素周期表中短周期的一部分,若X原子次外层电子数比最外层电子数多3,则下列说法正确的是( )
| R | ||
| X | Y | Z |
| A. | X的氢化物比R的氢化物稳定 | |
| B. | 原子半径大小顺序是Z>Y>X | |
| C. | Y元素能形成两种常见的含氧酸,其中一种是强酸 | |
| D. | XZ5分子中各原子均满足最外层8电子结构 |
1.关于麻黄碱的说法错误的是( )
| A. | 麻黄碱是国际奥委会严格禁止使用的兴奋剂 | |
| B. | 麻黄碱是从中药中提取的天然药物 | |
| C. | 麻黄碱能使人兴奋,运动员服用后能超水平发挥 | |
| D. | 麻黄碱有镇静催眠的效果 |
5.下列有关有机物的叙述正确的是( )
| A. | 烃的组成均符合通式CnH2n+2 | |
| B. | 有机物均不溶于水 | |
| C. | 甲烷在同系物中含碳量最高,是清洁能源 | |
| D. | 甲烷能发生取代反应 |
6.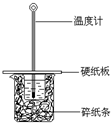 某同学按照课本实验要求,用50mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
 某同学按照课本实验要求,用50mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )
某同学按照课本实验要求,用50mL 0.50mol•L-1的盐酸与50mL 0.55mol•L-1的NaOH 溶液在如图所示的装置中进行中和反应.通过测定反应 过程中所放出的热量计算中和热.下列说法中,正确的是( )| A. | 实验过程中没有热量损失 | |
| B. | 图中实验装置缺少环形玻璃搅拌棒 | |
| C. | 烧杯间填满碎纸条的作用是固定小烧杯 | |
| D. | 若烧杯上不盖硬纸板,测得的△H将偏小 |