题目内容
15.人体血液里Ca2+的浓度一般采用mg/cm3来表示.抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用酸性KMnO4溶液滴定即可测定血液样品中Ca2+的浓度.某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度.[配制酸性KMnO4标准溶液]如图是配制50mL酸性KMnO4标准溶液的过程示意图.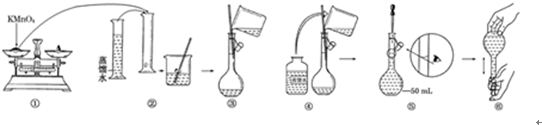
(1)请你观察图示判断其中不正确的操作有②⑤(填序号).
(2)其中确定50mL溶液体积的容器是50mL 容量瓶(填名称).
(3)如果按照图示的操作所配制的溶液进行实验,在其他操作均正确的情况下,所测得Ca2+的浓度将偏大(填“偏大”或“偏小”).[测定血液样品中Ca2+的浓度]抽取血样20.00mL,经过上述处理后得到草酸,再用0.020mol/L酸性KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗12.00mL酸性KMnO4溶液.
(4)已知草酸跟酸性KMnO4溶液反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mnx++10CO2↑+8H2O
则式中的x=2.
(5)用0.020mol/L酸性KMnO4溶液滴定,滴定终点现象溶液由无色变为紫红色,且半分钟不退色.
(6)经过计算,血液样品中Ca2+的浓度为1.2mg/cm3.
分析 (1)根据图示分析配制一定物质的量浓度的溶液的操作正误;
(2)容量瓶是确定溶液体积的仪器;
(3)根据仰视刻度线,会使溶液体积偏大判断,高锰酸钾的浓度偏小,在滴定草酸溶液时消耗的高锰酸钾的体积偏大;
(4)根据电荷守恒进行分析;
(5)草酸具有还原性,能够使高锰酸钾褪色;
(6)根据滴定数据及钙离子与高锰酸钾的关系式计算出血液样品中Ca2+的浓度.
解答 解:(1)由图示可知②⑤操作不正确,②不能在量筒中溶解固体,⑤定容时应平视刻度线,至溶液凹液面与刻度线相切,
故答案为:②⑤;
(2)应该用容量瓶准确确定50mL溶液的体积,则配制50mL溶液需要50mL容量瓶,故答案为:50mL容量瓶;
(3)如果用图示的操作配制溶液,由于仰视刻度线,会使溶液体积偏大,所配制的溶液浓度将偏小,在滴定草酸溶液时消耗的高锰酸钾的体积偏大,则测定的草酸的物质的量偏大,即测得Ca2+的浓度将偏大
故答案为:偏大;
(4)根据电荷守恒,(-1×2)+(+1×6)=+x×2,解得,x=2,草酸跟KMnO4反应的离子方程式为:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,
故答案为:2;
(5)草酸具有还原性,能够使高锰酸钾褪色,向无色草酸中加入酸性高锰酸钾,当草酸反应完后,滴加高锰酸钾显紫红色,且半分钟不退色,滴定到达终点;
故答案为:溶液由无色变为紫红色,且半分钟不退色;
(6)血样20.00mL经过上述处理后得到草酸,草酸消耗的消耗的高锰酸钾的物质的量为:0.020mol/L×0.012L=2.4×10-4mol,
根据反应方程式2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,及草酸钙的化学式CaC2O4,可知:n(Ca2+)=n(H2C2O4)=$\frac{5}{2}$n(MnO4-)=2.5×2.4×10-4mol=6
10-4mol,Ca2+的质量为:40g/mol×6×10-4mol=0.024g=24mg,
钙离子的浓度为:$\frac{24mg}{20c{m}^{3}}$=1.2 mg/cm3,
故答案为:1.2.
点评 本题考查了物质含量的测定、配制一定物质的量浓度的方法及误差分析,题目难度中等,注意掌握配制一定浓度的溶液的方法及误差分析方法及技巧.

| A. | 除去溴苯中的溴单质用氢氧化钠溶液 | |
| B. | 除去硝基苯中的二氧化氮用氢氧化钠溶液 | |
| C. | 除去甲烷中的乙烯用酸性高锰酸钾溶液 | |
| D. | 除去苯中的苯酚用氢氧化钠溶液 |
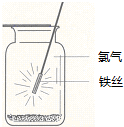
| A. | 铁丝应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铁丝插入集气瓶接近瓶底位置 | |
| C. | 将铁丝从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铁丝应不断上下移动 |
| A. | 提出原子学说 | B. | 首次人工合成有机物 | ||
| C. | 发现元素周期律 | D. | 发现氧气 |
| A. | ⅦA族元素是同周期中原子半径最大的元素 | |
| B. | ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数 | |
| C. | ⅦA族元素的最高正价都是+7价 | |
| D. | ⅦA族元素是同周期中非金属性最弱的元素 |
①只含有共价键的化合物不一定是共价化合物;
②全部由非金属元素形成的化合物一定为共价化合物;
③第IA族和第VIIA族原子化合时,一定生成离子键;
④白磷晶体中,白磷分子之间存在共价键;
⑤同素异形体在一定条件下的转化为物理变化;
⑥阴离子中不可能含有金属元素.
上述各种说法正确的是( )
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
| A. | s能级 | B. | p能级 | C. | d能级 | D. | f能级 |
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
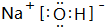 .
.