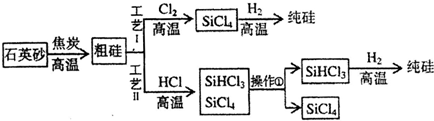
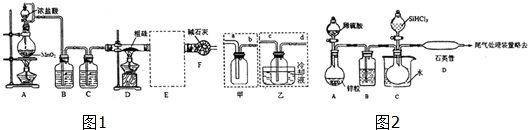
题目内容
17.S(单斜)和S(正交)是硫的两种同素异形体,下列说法正确的是,已知:①S(单斜,s)+O2(g)=SO2(g)△H1=-297.16kJ•mol-1
②S(正交,s)+O2(g)=SO2(g)△H2=-296.83kJ•mol-1
③S(单斜,s)=S(正交,s)△H3( )
| A. | △H3=0.33 kJ•mol-1 | |
| B. | 单斜硫转化为正交硫的反应是吸热反应 | |
| C. | 正交硫比单斜硫稳定 | |
| D. | 单斜硫比正交硫稳定 |
分析 A、根据盖斯定律可知,反应①-②=③,所以△H3=(-297.16kJ•mol-1)-(-296.83kJ•mol-1)=-0.33kJ/mol,
B、根据S(单斜,s)═S(正交,s)△H3=-0.33kJ/mol,反应放热;
C、能量高的物质不稳定,能量低的物质稳定;
D、能量高的物质不稳定,能量低的物质稳定.
解答 解:A、由盖斯定律可知,反应①-②=③,所以△H3=(-297.16kJ•mol-1)-(-296.83kJ•mol-1)=-0.33kJ/mol,故A错误;
B、S(单斜,s)═S(正交,s)△H3=-0.33kJ/mol,反应放热,故B错误;
C、根据S(单斜,s)═S(正交,s)△H3=-0.33kJ/mol,单斜硫的能量比正交硫的能量高,正交硫比单斜硫稳定,故C正确;
D、根据S(单斜,s)═S(正交,s)△H3=-0.33kJ/mol,单斜硫的能量比正交硫的能量高,正交硫比单斜硫稳定,故D错误;
故选C.
点评 本题考查化学能与热能,明确盖斯定律计算反应热及物质的能量与稳定性的关系即可解答,题目难度不大.

练习册系列答案
相关题目
7.现有如下各说法:
①只含有共价键的化合物不一定是共价化合物;
②全部由非金属元素形成的化合物一定为共价化合物;
③第IA族和第VIIA族原子化合时,一定生成离子键;
④白磷晶体中,白磷分子之间存在共价键;
⑤同素异形体在一定条件下的转化为物理变化;
⑥阴离子中不可能含有金属元素.
上述各种说法正确的是( )
①只含有共价键的化合物不一定是共价化合物;
②全部由非金属元素形成的化合物一定为共价化合物;
③第IA族和第VIIA族原子化合时,一定生成离子键;
④白磷晶体中,白磷分子之间存在共价键;
⑤同素异形体在一定条件下的转化为物理变化;
⑥阴离子中不可能含有金属元素.
上述各种说法正确的是( )
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
5.将一定量的乙烷完全燃烧,使所有的气体按顺序通过装有无水氯化钙和氢氧化钾的硬质玻璃管,氢氧化钾管的质量增加了4.4g,则乙烷在标准状况下体积( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
12.下列元素间易形成共价键的是( )
| A. | Na和Cl | B. | K和F | C. | H和Cl | D. | Ca和O |
2. 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是BCD.
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
 某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.
某化学实验小组想要了解市场上食用白醋(主要是醋酸的水溶液)的浓度,采用标准NaOH溶液对某品牌食用白醋进行滴定.(1)该实验应选用酚酞作指示剂,向锥形瓶中移取一定体积的白醋所用的仪器是酸式滴定管.
(2)如图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为25.40mL,此时滴定管中液体的体积大于24.60mL.
(3)为了减小实验误差,一共进行了三次实验,假设每次所取白醋体积均为VmL,标准NaOH溶液的浓度为c mol•L-1,三次实验结果记录如下:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.32 | 25.28 |
A.实验结束时俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.盛装标准液的滴定管未用标准液润洗
D.第一次滴定用的锥形瓶用待装液润洗
E.滴加NaOH溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定
(4)根据所给数据,写出该白醋中醋酸物质的量浓度的表达式(不必化简):$\frac{(25.32+25.28)•c}{2V}$mol/L.
9.下列关于环境污染的原因叙述正确的是( )
| A. | 重金属、农药等会造成水体污染 | |
| B. | 装饰材料中的甲醛、苯等会造成居室污染 | |
| C. | SO2会导致酸雨的形成 | |
| D. | 含磷洗涤剂大量使用易造成水华、赤潮 |
6.某原电池总反应离子方程式为.2Fe3++Fe?3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |