题目内容
16.三套装置如图所示,A、B、C烧杯中分别盛有相同物质的量浓度的稀硫酸.
(1)B中石墨电极的电极反应式为2H++2e-=H2↑.石墨电极附近溶液的pH值增大(填“增大”“减小”或“不变”).
(2)C中被腐蚀的金属是锌,总反应离子方程式是2H++Zn=H2↑+Zn2+.当外电路中有0.2mol电子通过导线时,消耗的金属质量为6.5g.
(3)比较A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C.
分析 (1)铁做负极,石墨做正极,电解质溶液为硫酸,则正极反应为2H++2e-=H2↑;
(2)锌比铁活泼,做原电池的负极而被氧化,负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,根据电子守恒计算消耗的金属质量;
(3)电化学腐蚀的速率大于化学腐蚀的速率,金属做原电池正极时得到保护;
解答 解:(1)B中铁做负极,石墨做正极,电解质溶液为硫酸,则石墨电极反应为2H++2e-=H2↑,消耗氢离子,所以石墨电极附近溶液的pH值增大,故答案为:2H++2e-=H2↑;增大;
(2)C形成原电池,锌比铁活泼,做原电池的负极而被氧化,负极反应为Zn-2e-=Zn2+,正极反应为2H++2e-=H2↑,所以总反应为:2H++Zn=H2↑+Zn2+,当外电路中有0.2mol电子通过导线时,消耗的金属质量为0.1×65=6.5g,故答案为:锌;2H++Zn=H2↑+Zn2+;6.5;
(3)A发生化学腐蚀,B发生电化学腐蚀,C锌比铁活泼,铁做原电池的正极而被保护,电化学腐蚀的速率大于化学腐蚀的速率,故答案为:B>A>C.
点评 本题考查金属的电化学腐蚀与防护,题目难度不大,注意金属的电化学腐蚀与化学腐蚀的区别,以及比较金属腐蚀快慢的方法.

练习册系列答案
相关题目
6.如图示意铁在氯气中燃烧的实验,铁丝点燃后,为维持燃烧继续,正确的操作是( ) 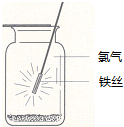

| A. | 铁丝应始终置于集气瓶瓶口位置 | |
| B. | 迅速将铁丝插入集气瓶接近瓶底位置 | |
| C. | 将铁丝从瓶口位置慢慢伸向瓶底位置 | |
| D. | 铁丝应不断上下移动 |
7.现有如下各说法:
①只含有共价键的化合物不一定是共价化合物;
②全部由非金属元素形成的化合物一定为共价化合物;
③第IA族和第VIIA族原子化合时,一定生成离子键;
④白磷晶体中,白磷分子之间存在共价键;
⑤同素异形体在一定条件下的转化为物理变化;
⑥阴离子中不可能含有金属元素.
上述各种说法正确的是( )
①只含有共价键的化合物不一定是共价化合物;
②全部由非金属元素形成的化合物一定为共价化合物;
③第IA族和第VIIA族原子化合时,一定生成离子键;
④白磷晶体中,白磷分子之间存在共价键;
⑤同素异形体在一定条件下的转化为物理变化;
⑥阴离子中不可能含有金属元素.
上述各种说法正确的是( )
| A. | ①②⑤正确 | B. | 都不正确 | ||
| C. | ④正确,其他不正确 | D. | 仅①不正确 |
4.下列能级中轨道数为7的是( )
| A. | s能级 | B. | p能级 | C. | d能级 | D. | f能级 |
11.下列关于各实验装置与对应现象或结论的叙述均正确的是( )
| A. |  如图装置:可用于分离石油,分别得到汽油、煤油和柴油等各种纯净物 | |
| B. |  用如图装置可制取并收集干燥纯净的NH3 | |
| C. |  如图装置:如果“a进b出”可用于收集NO2,如果“b进a出”可用于收集NH3 | |
| D. |  如图装置:持续通入CO2气体,现象是先出现白色沉淀,后变澄清 |
5.将一定量的乙烷完全燃烧,使所有的气体按顺序通过装有无水氯化钙和氢氧化钾的硬质玻璃管,氢氧化钾管的质量增加了4.4g,则乙烷在标准状况下体积( )
| A. | 0.56L | B. | 1.12L | C. | 2.24L | D. | 3.36L |
6.某原电池总反应离子方程式为.2Fe3++Fe?3Fe2+,不能实现该反应的原电池是( )
| A. | 正极为Cu,负极为Fe,电解质溶液为FeCl3 和HCl混合溶液 | |
| B. | 正极为C,负极为Fe,电解质溶液为Fe(NO3)3 和HNO3混合溶液 | |
| C. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和H2SO4混合溶液 | |
| D. | 正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 和HCl混合溶液 |