题目内容
【题目】含氮化合物在生产、生命活动中有重要的作用。回答下列问题:
(1)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,H2O(1)=H2O(g)△H3=+ckJ/mol,写出在298K时,氨气燃烧生成N2的热化学方程式___________。
(2)肌肉中的肌红蛋白(Mb)可与O2结合生成MbO2:Mb(aq)+O2(g)![]() MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
MbO2(aq),其中k正和k逆分别表示正反应和逆反应的速率常数,即V正=k正·c(Mb)·P(O2),V逆=k逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与O2结合的肌红蛋白占总肌红蛋白的百分比]:
P(O2) | 0.50 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 | 6.00 |
α(MbO2%) | 50.0 | 67.0 | 80.0 | 85.0 | 88.0 | 90.3 | 91.0 |
①计算37℃、P(O2)为2.00kPa时,上述反应的平衡常数K=___________。
②导出平衡时肌红蛋白与O2的结合度(α)与O2的压强[P(O2)]之间的关系式α=___________(用含有k正、k逆的式子表示)。
(3)构成肌红蛋白的甘氨酸(NH2CH2COOH)是一种两性物质,在溶液中以三种离子形式存在,其转化关系如下:
![]()
![]()
![]()
![]()
![]()
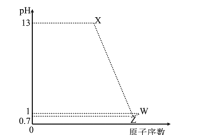
在甘氨酸溶液中加入酸或碱,三种离子的百分含量与的关系如图所示:
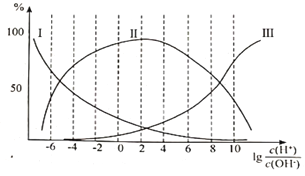
①纯甘氨酸溶液呈___________性;当溶液呈中性时三种离子的浓度由大到小的顺序为___________。
②向![]() =8的溶液中加入过量HCl时,反应的离子方程式为___________。
=8的溶液中加入过量HCl时,反应的离子方程式为___________。
③用电位滴定法可测定某甘氨酸样品的纯度.
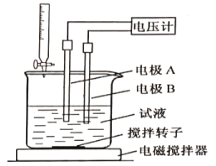
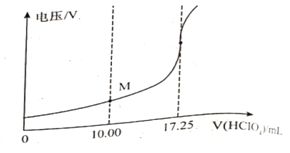
称取样品150mg,在一定条件下,用0.1000mol/L的高氯酸溶液滴定(与甘氨酸1︰1发生反应),测得电压变化与滴入HClO4溶液的体积关系如下图。做空白对照实验,消耗HClO4溶液的体积为0.25mL,该样品的纯度为___________%(计算结果保留一位小数)
【答案】4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol 2.00
kJ/mol 2.00 ![]() 酸 H3N+CH2COO->H2NCH2COO->H3N+CH2COOH H2NCH2COO-+2H+=H3N+CH2COOH 85.0
酸 H3N+CH2COO->H2NCH2COO->H3N+CH2COOH H2NCH2COO-+2H+=H3N+CH2COOH 85.0
【解析】
(1) 根据盖斯定律,将三个热化学方程式叠加,可得相应的热化学方程式;
(2)①根据平衡常数的含义,结合37℃、P(O2)为2.00kPa时a(MbO2)计算平衡常数;
②根据反应达到平衡时,V正=V逆,结合平衡常数定义式进行变性,可得表达式;
(3)①根据甘氨酸的存在形式与溶液酸碱性的关系,先判断I、II、III分别为H2NCH2COO-、H3N+CH2COO-和H3N+CH2COOH,若只含有H3N+CH2COO-,此时lg![]() ,结合溶液的Kw可判断溶液的pH、确定溶液的酸碱性;当溶液呈中性时,lg
,结合溶液的Kw可判断溶液的pH、确定溶液的酸碱性;当溶液呈中性时,lg![]() =0,根据图示判断微粒浓度大小;
=0,根据图示判断微粒浓度大小;
②根据lg![]() =8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,盐酸过量,H2NCH2COO-反应变为H3N+CH2COOH,书写反应方程式;
=8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,盐酸过量,H2NCH2COO-反应变为H3N+CH2COOH,书写反应方程式;
③结合滴定突跃时溶液体积读数与空白读数差,计算出消耗高氯酸的体积,利用n=cV计算出高氯酸的物质的量,根据恰好反应时甘氨酸与高氯酸的物质的量的比是1:1,计算出甘氨酸质量,利用甘氨酸质量与样品质量差计算得到甘氨酸的纯度。
(1) ①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-alkJ/mol,
②4NH3(g)+6NO(g)=5N2(g)+6H2O(g)△H2=-bkJ/mol,
③H2O(1)=H2O(g)△H3=+ckJ/mol,将①×3+②×2-③×30,整理可得热化学方程式:4NH3(g)+3O2(g)=2N2(g)+6H2O(l) △H=![]() kJ/mol;
kJ/mol;
(2)①37℃、P(O2)=2.00kPa时,结合度为80%,化学平均常数K=![]() kPa-1;
kPa-1;
②由结合度的定义式可知,反应达平衡时,V正=V逆,所以K=![]() ,可求出c(MbO2)=
,可求出c(MbO2)=![]() ,代入结合度定义式
,代入结合度定义式![]() =
=![]() 可得a=
可得a=![]() ;
;
①甘氨酸的三种存在形式:H3N+CH2COOH、H3N+CH2COO-和H2NCH2COO-应分别在强酸性至强碱性中存在,由此判断,图中I、II和III分别为H2NCHCOO-、H3N+CH2COO-和H3N+CH2COOH,当lg![]() =-8时,溶液显碱性,溶液中存在的主要是H2NCH2COO-,它与过量的HCl反应生成H3N+CH2COOH。由图可知纯甘氨酸溶液呈酸性(实际在5.9左右),溶液呈中性时,lg
=-8时,溶液显碱性,溶液中存在的主要是H2NCH2COO-,它与过量的HCl反应生成H3N+CH2COOH。由图可知纯甘氨酸溶液呈酸性(实际在5.9左右),溶液呈中性时,lg![]() =0,中性时H3N+CH2COO-> H2NCH2COO->H3N+CH2COOH;②根据lg
=0,中性时H3N+CH2COO-> H2NCH2COO->H3N+CH2COOH;②根据lg![]() =8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,由于加入的盐酸过量,所以,发生反应H2NCH2COO-变为H3N+CH2COOH,反应方程式为H2NCH2COO-+2H+=H3N+CH2COOH;
=8时,微粒存在有H2NCH2COO-、H3N+CH2COOH,由于加入的盐酸过量,所以,发生反应H2NCH2COO-变为H3N+CH2COOH,反应方程式为H2NCH2COO-+2H+=H3N+CH2COOH;
根据滴定曲线的突跃范围,消耗HClO4溶液17.25mL,减去空白实验的0.25mL,实际消耗滴定液17.00mL。n(HClO4)= 0.1000mol/L×0.01700L=0.0017mol,则n(甘氨酸)=0.0017mol,甘氨酸的质量为m(甘氨酸)=0.0017mol×75g/mol=0.1275g,所以甘氨酸的纯度为:(0.1275g÷0.150g)×100%=85.0%。

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案