题目内容
4.某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.已知:A装置烧瓶中固体为碱石灰,浓硫酸可以干燥氯气,F装置中发生的反应:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
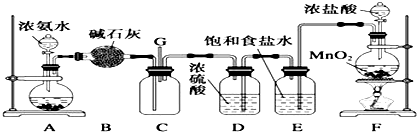
请回答下列问题:
(1)装置F中,若标况下生成2.24LCl2,则被氧化的盐酸物质的量为0.2mol
(2)写出实验室用氯化铵和熟石灰反应制取氨气的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(3)E装置的饱和食盐水能除去气体为HCl(氯化氢)
(4)A烧瓶中固体还可以是烧碱(氢氧化钠)、生石灰(填一种物质的名称)
(5)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气中无污染的主要成分之一.请写出反应的化学方程式:8NH3+3Cl2=N2+6NH4Cl
(6)从环境保护出发,本实验的缺陷是C中缺少尾气处理装置
(7)通入C装置的两根导管左边较长、右边较短,目的是使氨气与氯气能够混合均匀,快速且充分反应.
分析 (1)依据二氧化锰与浓盐酸制备氯气的方程式计算解答;
(2)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水;
(3)浓盐酸易挥发,制备的氯气中含有挥发的氯化氢和水蒸气杂质,依据氯气、氯化氢性质选择合适的除杂剂;
(4)氧化钙、氢氧化钠溶于水放出大量的热,能够促进氨水的挥发;
(5)氨气与氯气反应生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵固体;
(6)氯化氢、氨气、氯气等都能够污染空气需要进行尾气处理;
(7)氨气密度小于氯气密度,为使二者混合均匀充分反应,应左边较长、右边较短.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、水和氯气,方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,生成1mol氯气转移2mol电子,所以若标况下生成2.24LCl2,其物质的量为0.1mol,则转移电子的物质的量为0.2mol;
故答案为:0.2mol;
(2)氯化铵与氢氧化钙在加热条件下反应生成氨气、氯化钙和水,化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O
(3)浓盐酸易挥发,制备的氯气中含有挥发的氯化氢和水蒸气杂质,氯化氢极易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择饱和食盐水除去氯化氢;
故答案为:HCl(氯化氢);
(4)氧化钙、氢氧化钠溶于水放出大量的热,能够促进氨水的挥发;
故答案为:烧碱(氢氧化钠)、生石灰;
(5)氨气与氯气反应生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵固体,化学方程式为8NH3+3Cl2=N2+6NH4Cl;
故答案为:8NH3+3Cl2=N2+6NH4Cl;
(6)氯化氢、氨气、氯气等都能够污染空气需要进行尾气处理
故答案为:C中缺少尾气处理装置;
(7)氨气密度小于氯气密度,为使二者混合均匀充分反应,应左边较长、右边较短;
故答案为:使氨气与氯气能够混合均匀,快速且充分反应.
点评 本题考查了物质的制备,设计氨气、氯气的制备及性质的检验,熟悉反应原理及物质的性质是解题关键,题目难度中等.

| A. | C11H24、C27H56、C29H60三种物质互为同系物 | |
| B. | C33H68在常温下为液态 | |
| C. | C35H72中氢原子被氯气取代,最多需氯气35mol | |
| D. | 正二十一烷分子中所有碳原子在一条直线上 |
| A. | 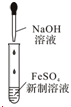 制备Fe(OH)2并观察颜色 | B. | 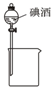 分离碘酒中的碘和酒精 | ||
| C. | 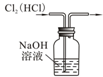 除去Cl2中的HCl | D. |  定容 |
| A. | 氧化铝的熔点很高,所以不可以用来冶炼铝 | |
| B. | 氢氧化铝是一种胶状沉淀,有较大表面积,有吸附性,可用作净水剂 | |
| C. | 实验室可以用氢氧化钠与氯化铝来制备氢氧化铝 | |
| D. | 氢氧化铝既可与强酸反应又可与强碱反应,是两性氢氧化物 |
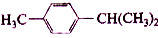 在核磁共振氢谱图中各信号的面积比为( )
在核磁共振氢谱图中各信号的面积比为( )| A. | 3:2:2:1:6 | B. | 3:4:1:3:3 | C. | 9:4:1 | D. | 3:4:7 |
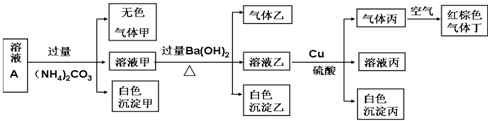
| A. | 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子 | |
| B. | 实验消耗Cu 14.4g,则生成气体丁的体积为3.36L | |
| C. | 沉淀乙一定有BaCO3,可能有BaSO4 | |
| D. | 一定没有Fe3+,但是无法确定是否含有I- |

| A. | CO2属于酸性氧化物 | |
| B. | CO与O形成化学键的过程中放出能量 | |
| C. | 钌催化剂可以改变该反应的焓变 | |
| D. | CO与O形成化学键的过程中有电子转移 |
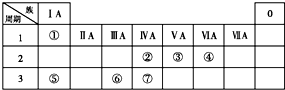 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题: