题目内容
19.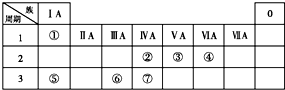 下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:
下表为元素周期表的一部分,请参照①~⑦相关元素在表中的位置,用化学用语回答下列问题:(1)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>O;
②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是HNO3>H2CO3>H2SiO3
(2)由②、④、⑤三种元素组成的常见物质的水溶液显碱性,用离子方程式表示溶液显碱性的原因:CO32-+H2O?HCO3-+OH-
(3)甲是由②、④二种元素的还原剂,工业上常用来冶炼金属,请用化学方程式表示它在工业上的一种冶炼常用金属的化学方程式3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2
(4)已知在25℃、101kPa下,⑦的气态氢化物在氧气中完全燃烧后恢复至原状态,每转移1mol电子时放热190.0kJ,该反应的热化学方程式可表示为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol.
(5)以⑥的单质材料为阳极,石墨做阴极,NaHCO3溶液做电解液进行电解,生成有吸附性的难溶物R,写出阳极生成R的电极反应式:Al-3e-=Al3+,Al3++3HCO3-═Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大;非金属性越强,最高价含氧酸的酸性越强;
(2)由②、④、⑤三种元素组成的常见物质为Na2CO32-,CO32-水解溶液呈碱性;
(3)甲是由②、④二种元素的还原剂,工业上常用来冶炼金属,则甲为CO,工业常用CO与氧化铁反应冶炼Fe,反应生成Fe与二氧化碳;
(4)⑦的气态氢化物为SiH4,燃烧发生反应:SiH4+2O2=SiO2+2H2O,转移1mol电子时,参加反应的SiH4为$\frac{1mol}{4-(-4)}$=0.125mol,计算1molSiH4燃烧放出的热量,注明物质的聚集状态与反应热书写热化学方程式;
(5)阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si.
(1)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故原子半径:Na>Al>O;非金属性N>C>Si,非金属性越强,最高价含氧酸的酸性越强,故酸性:HNO3>H2CO3>H2SiO3,
故答案为:Na>Al>O;HNO3>H2CO3>H2SiO3;
(2)由②、④、⑤三种元素组成的常见物质为Na2CO32-,CO32-水解溶液呈碱性,水解离子方程式为:CO32-+H2O?HCO3-+OH-,
故答案为:CO32-+H2O?HCO3-+OH-;
(3)甲是由②、④二种元素的还原剂,工业上常用来冶炼金属,则甲为CO,工业常用CO与氧化铁反应冶炼Fe,反应生成Fe与二氧化碳,反应方程式为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2,
故答案为:3CO+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;
(4)⑦的气态氢化物为SiH4,燃烧发生反应:SiH4+2O2=SiO2+2H2O,转移1mol电子时,参加反应的SiH4为$\frac{1mol}{4-(-4)}$=0.125mol,1molSiH4燃烧放出的热量为190.0kJ×$\frac{1mol}{0.125mol}$=1520.0 kJ,反应热化学方程式为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1520.0 kJ/mol;
(5)阳极上铝失电子生成铝离子,铝离子和碳酸氢根离子发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应方程式为:Al-3e-=Al3+,Al3++3HCO3-═Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑,
故答案为:Al-3e-=Al3+,Al3++3HCO3-═Al(OH)3↓+3CO2↑或Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑.
点评 本题考查元素周期表与元素周期律,需要学生熟练掌握元素周期表的结构,侧重对元素周期律与化学用语的考查.

 名校课堂系列答案
名校课堂系列答案| A. | 锌粒与稀硫酸的反应 | |
| B. | 酸碱中和的反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
| A. | SO2 | B. | H2S | C. | S | D. | H2O |
| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO42-总物质的量为0.9 mol | |
| B. | 当1 L水吸收22.4 L氨气时所得氨水的浓度不是1 mol•L-1,只有当22.4 L氨气溶于水制得1 L氨水时,其浓度才是1 mol•L-1 | |
| C. | 在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,冷却到10℃时,其体积小于100 mL,它的物质的量浓度仍为0.35 mol•L-1 |
| A. | 煤的主要组成为苯以及苯的同系物 | |
| B. | “可燃冰”为水可能变成油提供了有力的证据 | |
| C. | 油脂、淀粉、纤维素、蛋白质都是高分子化合物 | |
| D. | 石油的裂解是使石油分馏产物中的长链烃断裂成乙烯、丙烯等气态短链烃 |
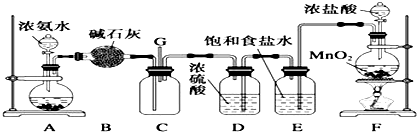
 某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题: .
.
 三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.
三氟化氮(NF3)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用.它可在铜的催化作用下由F2和过量的NH3反应得到,该反应另一种产物为盐.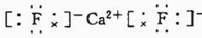 .
.