题目内容
19.下列说法正确的是( )| A. | C11H24、C27H56、C29H60三种物质互为同系物 | |
| B. | C33H68在常温下为液态 | |
| C. | C35H72中氢原子被氯气取代,最多需氯气35mol | |
| D. | 正二十一烷分子中所有碳原子在一条直线上 |
分析 A.C11H24、C27H56、C29H60都是烷烃,结构相似,分子间相差n个CH2原子团;
B.由17个碳以上组成的烷烃常温下为固态;
C.烃中每取代1个H原子,需要消耗1mol氯气;
D.烷烃分子中,每个碳原子周围的原子形成四面体结构.
解答 解:A.C11H24、C27H56、C29H60都属于烷烃,具有相似结构,且分子间相差n个CH2原子团,互为同系物,故A正确;
B.烷烃中原子数大于17时为固态,则C33H68在常温下为固态,故B错误;
C.C35H72中含有72gH原子,其分子中所有氢原子被氯气取代,最多需氯气72mol,故C错误;
D.烷烃分子中,每个碳原子周围的原子形成的是四面体结构,则正二十一烷分子中不可能所有的碳原子在一条直线上,故D错误;
故选A.
点评 本题考查了有机物结构与性质、同系物判断等知识,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握同系物的概念及判断方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.等质量的烃完全燃烧,消耗氧气最多的是( )
| A. | CH4 | B. | C2H6 | C. | C2H2 | D. | C6H6 |
4.下列物质可用来干操Cl2的是( )
①碱石灰;
②浓硫酸;
③无水CaCl2;
④P2O5.
①碱石灰;
②浓硫酸;
③无水CaCl2;
④P2O5.
| A. | ①② | B. | ①③④ | C. | ①②③④ | D. | ②③④ |
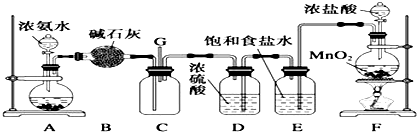
6. 实验室可用如图装置制取少量NaHSO3
实验室可用如图装置制取少量NaHSO3
(1)装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁中的反应的离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(4)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管;2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1mol/L氢氧化钡溶液、品红溶液、蒸馏水.
请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
 实验室可用如图装置制取少量NaHSO3
实验室可用如图装置制取少量NaHSO3(1)装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁中的反应的离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(4)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管;2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1mol/L氢氧化钡溶液、品红溶液、蒸馏水.
请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
步骤一、取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置 | 若产生白色沉淀(或浑浊)(填实验现象), 则产物中存在Na2SO3,否则无该物质. |
步骤二、取步骤一所得的上层澄清溶液少许与试管中,向其中加入过量lmol/L氢氧化钡溶液 | 若产生若产生白色沉淀(或浑浊)(填实验现象),则产物中存在NaHSO3,否则无该物质. |
3.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的时间段(即0~1、l~2、2~3、3~4、4~5min)为2min~3min,原因是反应放热,温度升高,加快反应速率.
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.