题目内容
12.下列有关铝化合物说法正确的是( )| A. | 氧化铝的熔点很高,所以不可以用来冶炼铝 | |
| B. | 氢氧化铝是一种胶状沉淀,有较大表面积,有吸附性,可用作净水剂 | |
| C. | 实验室可以用氢氧化钠与氯化铝来制备氢氧化铝 | |
| D. | 氢氧化铝既可与强酸反应又可与强碱反应,是两性氢氧化物 |
分析 A.氧化铝熔点很高,为降低其熔点,常常加入冰晶石来冶炼铝;
B、明矾溶于水可形成胶状物使水中悬浮颗粒沉降下来;
C、氢氧化铝可以溶于过量的氢氧化钠中,碱的量不好控制;
D、氢氧化铝既可与强酸反应又可与强碱反应生成盐和水,属于两性氧化物.
解答 解:A、虽然氧化铝熔点很高,但氯化铝又是共价化合物,所以只能选择氧化铝来冶炼铝,为降低其熔点,常常加入冰晶石来冶炼铝,故A错误;
B、氢氧化铝溶于水可形成胶体,有较大表面积,有吸附性,可以和悬浮于水中的泥沙形成絮状不溶物沉降下来,使水澄清,所以明矾可用作净水剂,故B正确;
C、氢氧化铝可以溶于过量的氢氧化钠中,碱的量不好控制,用可溶性的铝盐和氨水反应来制取氢氧化铝,故C错误;
D、氢氧化铝既可与强酸反应又可与强碱反应生成盐和水,属于两性氧化物,故D正确.
故选BD.
点评 本题考查学生铝以及化合物的性质,注意知识的归纳和梳理是解题的关键,难度不大.

练习册系列答案
 阶梯计算系列答案
阶梯计算系列答案
相关题目
3.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的时间段(即0~1、l~2、2~3、3~4、4~5min)为2min~3min,原因是反应放热,温度升高,加快反应速率.
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
17.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
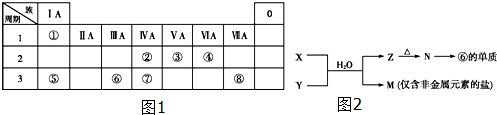
(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生如图2反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).

(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).
1.下列说法正确的是( )
| A. | 乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体 | |
| B. | 润滑油属于酯类 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
2.电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池,反应原理为PbO2+Pb+2H2SO4$?_{充电}^{放电}$2PbSO4+2H2O,下列叙述正确的是( )
| A. | 电池放电时,PbO2是电池的正极,被氧化 | |
| B. | 电池放电时,SO42-只在负极发生反应 | |
| C. | 电池充电时,溶液的pH不断增大 | |
| D. | 电池充电时,阳极反应式为PbSO4+2H2O-2e-═PbO2+SO42-+4H+ |




 某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题: .
.