题目内容
9.实验室用13 克锌与含HCl 0.8mol的盐酸溶液反应制取氢气.(1)反应制得的氯化锌的物质的量为多少?
(2)在标准状况下 可收集到的氢气多少体积?
分析 首先应根据反应物、生成物、反应条件正确的写出化学方程式,然后根据方程式找出锌与氢气的质量关系,从而求出制得氢气的质量,再根据公式:V=nVm,计算求解.
解答 解:设反应制得的氯化锌的X mol,标准状况下收集到的氢气为Y L
Zn+2HCl═ZnCl2+H2↑
65g 1 mol 22.4 L
13g X mol Y L
$\frac{65}{13}=\frac{1}{X}=\frac{22.4}{Y}$
解之得:X=0.2;Y=4.48;
答:(1)反应制得的氯化锌的0.2 mol;(2)标准状况下收集到的氢气为4.48L.
点评 本题是一道根据化学方程式进行综合计算题,考查了同学们用化学知识分析解决问题的能力,学生只要注意相关公式的运用即可,比较容易.

练习册系列答案
相关题目
4.下列物质可用来干操Cl2的是( )
①碱石灰;
②浓硫酸;
③无水CaCl2;
④P2O5.
①碱石灰;
②浓硫酸;
③无水CaCl2;
④P2O5.
| A. | ①② | B. | ①③④ | C. | ①②③④ | D. | ②③④ |
17.如图1为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
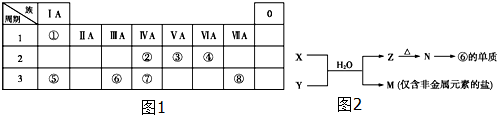
(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
(4)由表中元素形成的常见物质X、Y、Z、M、N可发生如图2反应:
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).

(1)写出由④、⑤、⑧元素形成的既含离子键又含共价键的一种离子化合物的化学式:NaClO.
(2)含元素⑧的单质能与自来水中的有机物反应生成对人体有危害的物质,现已逐步淘汰.下列可代替它作自来水消毒剂的是AC.
A.ClO2 B.AlCl3 C.K2FeO4
(3)W与④是相邻的同主族元素.在下表中写出H2WO3相应性质的化学方程式.
| 编号 | 性质 | 化学方程式 |
| 1 | 还原性 | H2SO3+Br2+2H2O═H2SO3+2HBr |
| 2 | 酸性 | H2SO3+2NaOH=Na2SO3+2H2O |
X溶液与Y溶液反应的离子方程式为Al3++3NH3+3H2O═Al(OH)3↓+3NH4+;
M中阳离子的鉴定方法是取少量M样品放入试管,加入氢氧化钠溶液,加热,产生能使湿润的红色石蕊试纸变蓝的气体,证明有铵根离子;
如果M中含有元素⑧,M溶液中离子浓度由大到小的排列顺序是c(Cl-)>c(NH+4)>c(H+)>c(OH-).
1.下列说法正确的是( )
| A. | 乙酸是一种弱酸,不能和碳酸钙反应放出二氧化碳气体 | |
| B. | 润滑油属于酯类 | |
| C. | 没有成熟的苹果汁遇碘变蓝色,成熟的苹果汁能还原新制氢氧化铜悬浊液 | |
| D. | 糖类、油脂、蛋白质都是由C、H、O三种元素组成 |
19.在一密闭容器中有如下反应:aX(g)+bY(g)?nW(g)△H=Q.某化学兴趣小组的同学根据此反应在不同条件下的实验数据,作出了如下曲线图:

其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条件不变时,下列分析可能正确的是( )

其中,ω(W)表示W在反应混合物中的百分含量,t表示反应时间.其它条件不变时,下列分析可能正确的是( )
| A. | 图Ⅰ可能是不同压强对反应的影响,且P2>P1,a+b<n | |
| B. | 图Ⅲ可能是不同温度对反应的影响,且T1>T2,Q<0 | |
| C. | 图Ⅱ可能是不同压强对反应的影响,且P1>P2,n<a+b | |
| D. | 图Ⅱ可能是在同温同压下催化剂对反应的影响,且2表示使用催化剂后的反应过程 |
 、
、 ,该反应的化学方程式为:2CO2+Na2O2═2Na2CO3+O2.
,该反应的化学方程式为:2CO2+Na2O2═2Na2CO3+O2.