题目内容
15.下列装置所示的实验能达到实验目的是( )| A. | 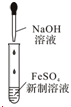 制备Fe(OH)2并观察颜色 | B. | 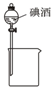 分离碘酒中的碘和酒精 | ||
| C. | 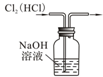 除去Cl2中的HCl | D. |  定容 |
分析 A.应防止Fe(OH)2被氧化;
B.碘和酒精混溶;
C.二者都与氢氧化钠反应;
D.定容时,眼睛与刻度线水平相切,且用胶头滴管滴加液体.
解答 解:A.制备Fe(OH)2,应将滴管插入液面以下,防止氢氧化亚铁被氧化,故A错误;
B.碘和酒精混溶,应用蒸馏的方法分离,故B错误;
C.二者都与氢氧化钠反应,应用饱和食盐水分离,故C错误;
D.定容时,眼睛与刻度线水平相切,且用胶头滴管滴加液体,可达到实验目的,故D正确.
故选D.
点评 本题考查较为综合,涉及物质的分离、溶液的配制以及氢氧化亚铁的制备等,侧重于学生评价能力和实验能力的考查,为高考常见题型,难度不大.

练习册系列答案
相关题目
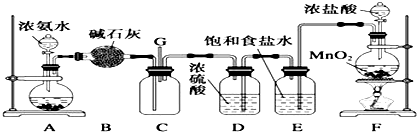
6. 实验室可用如图装置制取少量NaHSO3
实验室可用如图装置制取少量NaHSO3
(1)装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁中的反应的离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(4)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管;2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1mol/L氢氧化钡溶液、品红溶液、蒸馏水.
请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
 实验室可用如图装置制取少量NaHSO3
实验室可用如图装置制取少量NaHSO3(1)装置乙的作用是防止丙中液体倒吸入装置甲中(或缓冲瓶的作用).
(2)装置丁中的反应的离子方程式为5SO2+2MnO4-+2H2O═5SO42-+2Mn2++4H+.
(3)反应过程中,将丙中滴管里的品红溶液滴入锥形瓶,若现象为品红溶液褪色,则溶液中的NaOH完全转化为了NaHSO3.
(4)若丙中没有加入品红溶液,则不能准确判断氢氧化钠是否完全转化.现有可供选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管;2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、1mol/L氢氧化钡溶液、品红溶液、蒸馏水.
请设计实验探究吸收后产物中是否存在NaHSO3和Na2SO3,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论 |
步骤一、取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液,静置 | 若产生白色沉淀(或浑浊)(填实验现象), 则产物中存在Na2SO3,否则无该物质. |
步骤二、取步骤一所得的上层澄清溶液少许与试管中,向其中加入过量lmol/L氢氧化钡溶液 | 若产生若产生白色沉淀(或浑浊)(填实验现象),则产物中存在NaHSO3,否则无该物质. |
3.(1)已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
①反应速率最大的时间段(即0~1、l~2、2~3、3~4、4~5min)为2min~3min,原因是反应放热,温度升高,加快反应速率.
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 30 | 120 | 280 | 350 | 370 |
②反应速率最小的时间段(即0~1、l~2、2~3、3~4、4~5min)为4min-5min,原因是浓度减小,反应速率慢.
(2)另一学生也做同样的实验,由于反应太快,测量氢气的体积时不好控制,他就采取下列措施以减慢反应速率
A.加少量蒸馏水 B.把锌块换成锌粉 C.加少量NaCl溶液
你认为他上述做法中可行的是AC(填相应字母);做法中不可行的理由是加入更加细小的锌粒,增大接触面积,使反应速率加快.
10.下列反应属于吸热反应的是( )
| A. | 锌粒与稀硫酸的反应 | |
| B. | 酸碱中和的反应 | |
| C. | 甲烷在氧气中的燃烧反应 | |
| D. | Ba(OH)2•8H2O晶体与NH4Cl晶体的反应 |
 某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题:
某同学应用右图所示的方法研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸气.回答下列问题: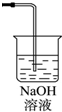 .
.