题目内容
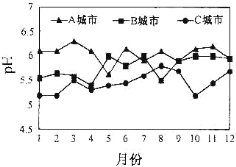
【题目】常温下,用0.10 mol/L的NaOH溶液分别滴定体积均为50.00 mL、浓度均为0.05 mol/L的HClO、HF两种溶液,其滴定曲线如图所示。
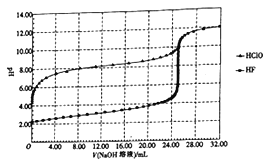
下列说法正确的是
A.HClO的酸性比HF强
B.V(NaOH)=0mL时,对应溶液中:c(ClO-)=c(F-)
C.V(NaOH)=12.50mL时,对应溶液中:c(ClO-)>c(F-)
D.V(NaOH)=25.00mL时,对应溶液中:c(ClO-)<c(F-)
【答案】D
【解析】
A.浓度均为0.05 mo1/L的HClO、HF,溶液的pH越小,酸的酸性越强,滴定前HF的pH小,所以酸性HF>HClO,A错误;
B.电离程度越大,溶液中酸根离子的浓度越大,滴定前,HF中酸根离子浓度大,即c(ClO-)<c(F-),B错误;
C.V(NaOH)=12.50mL时,溶液中溶质分别为等浓度的NaClO和HClO、NaF和HF,由于HF的电离程度大于HClO,所以对应溶液中:c(ClO-)<c(F-),C错误;
D.V(NaOH)=25.00mL时,两种溶液中的溶质分别为等浓度的NaClO、NaF,由于NaClO的水解程度大于NaF,所以c(ClO-)<c(F-),D正确;
故合理选项是D。

练习册系列答案
相关题目