题目内容
【题目】如图是甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应,电池总反应为2CH3OH +3O2![]() 2CO2+ 4H2O。下列说法不正确的是
2CO2+ 4H2O。下列说法不正确的是
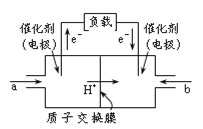
A.左电极为电池的负极,a处通入的物质是甲醇
B.正极反应式为:O2+ 2H2O + 4e-= 4OH-
C.负极反应式为:CH3OH + H2O-6e- = CO2+ 6H+
D.该电池提供1mole-,消耗氧气0.25mol
【答案】B
【解析】
A、左电极是电池的负极,负极上投放燃料甲醇,甲醇在负极上失电子发生氧化反应,故A正确;
B、酸性条件下,正极反应式为:O2+4H++4e-=2H2O,故B错误;
C、负极上投放燃料甲醇,甲醇在负极上失电子生成二氧化碳,负极反应式为:CH3OH+H2O-6e-=CO2+6H+,故C正确;
D、已知正极反应式为:O2+4H++4e-=2H2O,则消耗1mol氧气转移1mol电子,所以该电池提供1mole-,消耗氧气0.25mol,故D正确;
故选B。

 名校课堂系列答案
名校课堂系列答案【题目】某烧碱样品因部分变质含Na2CO3。某化学课外小组的同学用滴定法测定该烧碱样品中NaOH的质量分数。
(资料)常用的酸碱指示剂及其变色范围如下:
酚酞:pH<8.2 无色 8.2<pH<10浅红色 pH>10 红色
甲基橙:pH<3.1红色 3.1<pH<4.4橙色 pH>4.4 黄色
(实验步骤)
I. 迅速地称取烧碱样品0.50g,溶解后配制成100 mL溶液,备用。
Ⅱ.将0.1000mol/L HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取20.00 mL样品溶液于锥形瓶中,滴加2滴酚酞;以HCl标准溶液滴定至第一终点(此时溶质为NaCl和NaHCO3),记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用HCl标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
实验序号 | 1 | 2 | 3 |
V0/ mL | 0.00 | 0.00 | 0.00 |
V1/ mL | 21.72 | 21.68 | 21.70 |
V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(2)下列有关步骤I中样品溶液的说法正确的是________(填字母序号)。
a. 样品溶液中水的电离程度比相同pH的NaOH溶液中的小
b. c(OH-)>c(CO32-)>c(HCO3-)
c. c(H+)+ c(Na+)=c(CO32-)+c(HCO3-)+ c(OH-)
d. 向该溶液中滴加盐酸至第一终点时,n(Cl-)+n(CO32-)+n( HCO3-)+n(H2CO3)=n(Na+)
(3)酸式滴定管用蒸馏水洗净后、装入标准溶液前,应进行的操作是_______。
(4)滴定至第一终点的过程中,发生反应的离子方程式为_____。
(5)判断滴定至第二终点的现象是溶液由___色变为橙色。
(6)样品中NaOH的质量分数w(NaOH)= _____%。(计算结果保留小数点后1位)
(7)下列操作会导致测得的NaOH质量分数偏高的是____(填字母序号)。
a. 达到第一终点前,锥形瓶中有气泡产生
b. 记录酸式滴定管读数V1时,俯视标准液液面
c. 第一终点后继续滴定时,锥形瓶中有少许液体溅出