题目内容
【题目】(1)下列各组化合物中,化学键类型和化合物类型均相同的是_________(填序号)。
A.CaCl2和 Na2S B.Na2O 和 Na2O2
C.CO2和CaO D.HC1 和 NaOH
(2)已知1 mol石墨转化为1 mol金刚石要吸收能量,则1 mol石墨的能量比1 mol金刚石的能量____(填“高”或“低”),石墨比金刚石_______(填“稳定”或“不稳定”)。
(3)Ba(OH)2 8H2O和NH4Cl反应的化学方程式是____________,该反应是___(填“吸热”或“放热”)反应,反应过程能量变化的图像符合_____________(填“图1”或“图2”)。
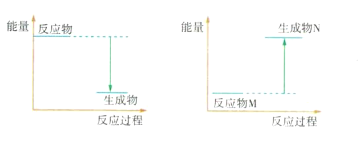
图1 图2
(4)如图3所示,把试管放入盛有饱和澄清石灰水(温度为25℃)的烧杯中,先在试管中放入几小块镁片,再用滴管滴入5mL盐酸。可以观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是___________________________。
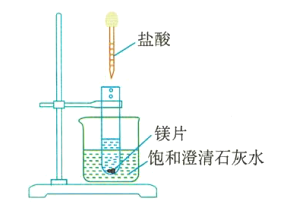
图3
【答案】A 低 稳定 ![]() 吸热 图2 Mg与盐酸反应放出热量,烧杯中饱和澄清石灰水的温度升高,Ca(OH)2的溶解度降低,从溶液中析出
吸热 图2 Mg与盐酸反应放出热量,烧杯中饱和澄清石灰水的温度升高,Ca(OH)2的溶解度降低,从溶液中析出
【解析】
(1)A.CaCl2和NazS均只含有离子键,且均为离子化合物,A项正确;
B.虽然Na2O和Na2O2均为离子化合物,但Na2O只含有离子键,Na2O2含有离子键和共价键,B项错误;
C.CO2含有共价键,是共价化合物,CaO含有离子键,是离子化合物,C项错误;
D.HCl含有共价键,是共价化合物,NaOH含有离子键和共价键,是离子化合物,D项错误。
故选A。
(2)由1 mol石墨转化为1 mol金刚石要吸收能量,金刚石吸收能量后,能量变高,则1 mol石墨的能量比1 mol金刚石的能量低,石墨比金刚石稳定。
故答案为:低;稳定;
(3)Ba(OH)2 8H2O与NH4C1发生复分解反应,生成BaCl2、NH3和H2O,Ba(OH)2 8H2O和NH4Cl反应的化学方程式是![]() ,该反应吸收热量,故生成物总能量比反应物总能量高,图2生成物总能量高,故图2符合。
,该反应吸收热量,故生成物总能量比反应物总能量高,图2生成物总能量高,故图2符合。
故答案为:![]() ;吸热;图2 ;
;吸热;图2 ;
(4)观察到烧杯中的石灰水逐渐由澄清变浑浊,出现这种现象的原因是:Mg与盐酸反应放出热量,导致石灰水温度升高,而Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2固体,从而使溶液浑浊。
故答案为:Mg与盐酸反应放出热量,导致石灰水温度升高,而Ca(OH)2在水中的溶解度随温度的升高而减小,故析出Ca(OH)2固体,从而使溶液浑浊。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。
【题目】煤气中主要的含硫杂质有H2S以及CS2、COS等有机硫,煤气燃烧后含硫杂质会转化成SO2从而引起大气污染。煤气中H2S的脱除程度已成为其洁净度的一个重要指标,脱除煤气中H2S的方法有干法脱硫和湿法脱硫,其中湿法脱硫的原理是利用Na2CO3溶液吸收H2S生成NaHS,再进一步被空气氧化成Na2S2O3。
请回答下列问题:
(1)①Na2S2O3的化学名称为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法以及水解法等。
①COS的分子结构与CO2相似,COS的电子式为_____________。
②Br2的KOH溶液将COS氧化为硫酸盐和碳酸盐的离子方程式为___________________;增大压强,COS的转化率_____________(填“提高”、“不变”或“降低”)。
③已知断裂1mol化学键所需的能量如下:
化学键 | H—H | C═O | C═S | H—S |
|
E/kJmol-1 | 436 | 745 | 577 | 339 | 1072 |
H2还原COS发生的反应为H2(g)+COS(g) ═H2S(g)+CO(g),该反应的ΔH=________kJ·mol-1。
④用活性α—Al2O3催化COS水解的反应为COS(g)+ H2 O(g) ![]() CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与
CO2(g)+ H2S (g) ΔH<0,相同投料比、相同流量且在催化剂表面停留相同时间时,在相同的时间内测得不同温度下COS的转化率(未达平衡)如图1所示;某温度下,COS的平衡转化率与![]() 的关系如图2所示。
的关系如图2所示。


由图1可知,催化剂活性最大时对应的温度约为_______;由图2可知,P点时平衡常数K=____________(保留2位有效数字)。
(3)回收处理燃煤烟气中SO2的方法之一是用氨水先将SO2转化为NH4HSO3,再通入空气将其氧化成(NH4)2SO4。能提高燃煤烟气中SO2去除率的措施有__________(填字母)。
a.增大氨水浓度 b.增大燃煤烟气的流速 c.升高温度 d.增大压强


