题目内容
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。巳知A和B均为短周期元素,其原子的第一至第四电离能如下表所示:

(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了_______。

(2)ACl2分子中A的杂化类型为_______。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45pm,C60中C—C键长为145?140pm,有同学据此认为C60的熔点高于金刚石,你认为此说法是否正确_______ (填“正确”或“不正确”),并阐述理由。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质中K原子和C60分子的个数比为_______。

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是_______,NCl3分子的价层电子对互斥理论模型为_______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足 8电子稳定结构,则分子中π键的数目为_______

(1)某同学根据上述信息,推断B的核外电子排布如图所示,该同学所画的电子排布图违背了_______。

(2)ACl2分子中A的杂化类型为_______。
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。已知金刚石中的C—C的键长为154.45pm,C60中C—C键长为145?140pm,有同学据此认为C60的熔点高于金刚石,你认为此说法是否正确_______ (填“正确”或“不正确”),并阐述理由。
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。写出基态钾原子的价电子排布式 ,该物质中K原子和C60分子的个数比为_______。

(5)继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是_______,NCl3分子的价层电子对互斥理论模型为_______。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足 8电子稳定结构,则分子中π键的数目为_______
(1)能量最低原理
(2)sp杂化
(3)不正确。C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键,而分子间作用力较弱,所需能量较低,故C60熔点低于金刚石。
(4)4s1 3:1
(5)N>C>Si 正四面体 30
试题分析:(1)从图上看,3p轨道电子应排布在3s轨道上,这违背了能量最低原理。
(2)从A的第一至第四电离能看,A的第三电离能发生突变,因此A最外层有2个电子,根据ABn型分子价电子对的计算方法,分子中有
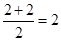 个电子对,因此为直线型,中心原子杂化方式为sp杂化。
个电子对,因此为直线型,中心原子杂化方式为sp杂化。(3)结构决定性质,对于物质熔、沸点的分析应从物质的晶体类型来分析。
(4)基态钾原子的核外电子排布为1s22s22p63s23p64s1,价电子为4s1。
晶胞中的K原子在面上,对晶胞的贡献为
 ,每个晶胞中含有K原子的个数为
,每个晶胞中含有K原子的个数为 个;C60在晶胞的顶点和中心,因此每个晶胞中C60的分子数位
个;C60在晶胞的顶点和中心,因此每个晶胞中C60的分子数位 个,因此K原子和C60分子的个数比为6:2=3:1。
个,因此K原子和C60分子的个数比为6:2=3:1。(5)同一周期元素电负性自左向右逐渐增大,同一主族元素电负性自上向下逐渐减小,因此电负性由大到小的顺序为N>C>Si。
根据ABn型分子价电子对计算方法,可知NCl3的价电子对为4个,中心原子为sp3杂化,分子构型为正四面体。
根据题意可知每个Si原子形成4个共价键,其中3个σ键,1个π键,即π键为化学键总数的
 ,60个原子可形成化学键总数为
,60个原子可形成化学键总数为 个,因此π键数为
个,因此π键数为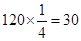 个。
个。
练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案
相关题目



 若
若



 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。