题目内容
冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2 +9H2O。
(1)熔融晶体A时痛要破坏的作用力是 ,冰晶石中的配位体是 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为 ,该分子的空间构型为 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小: ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种) 、 。
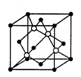
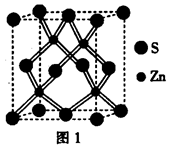
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g? cm-3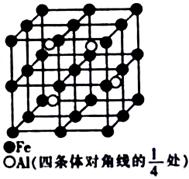
(1)熔融晶体A时痛要破坏的作用力是 ,冰晶石中的配位体是 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为 ,该分子的空间构型为 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小: ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种) 、 。
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为 。若晶胞的边长为a nm,则合金的密度为 g? cm-3

(1)离子键;F- (2)sp;直线型
(3)2F2+2H2O==4HF+O2;H2O(或其他合理答案);O3
(4)Fe2Al(或AlFe2);
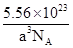
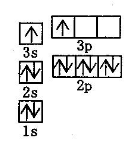
试题分析:(1)根据原子守恒可知A为Na2CO3,属于离子化合物,反应中会破坏离子键。Na3AlF6中AlF6-是配离子,Al是中心原子,F-为配位体。
(2)CO2是非极性分子,中心原子C的轨道杂化方式为sp,分子构型是直线型。
(3)相邻的两种元素是F和O,F的电负性较大,非金属性强,F2可将水中的氧置换出来。含有O且分子构型是“V”型的分子有H2O、SO2、O3等。
(4)晶胞中含有铁原子个数为
 个,含有Al原子为4个,因此化学式为Fe2Al。设该晶胞的密度为ρ,则有ρ·(a×10-7)3·NA=4×(56×2+27),则ρ=
个,含有Al原子为4个,因此化学式为Fe2Al。设该晶胞的密度为ρ,则有ρ·(a×10-7)3·NA=4×(56×2+27),则ρ=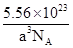 。
。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 、
、 两种可能,经证实
两种可能,经证实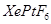 不溶于
不溶于 等非极性溶剂。”据此可确定
等非极性溶剂。”据此可确定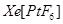 中化学键类型为________。
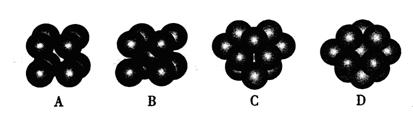
中化学键类型为________。 采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,
采用“…ABCABC…”型堆积方式,抽出一个晶胞,其正确的是________,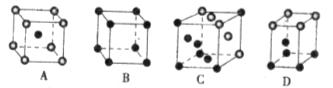
 则Pt原子的半径为_________pm(Pt的相对原子质量195.1)
则Pt原子的半径为_________pm(Pt的相对原子质量195.1)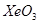 和
和 ,它们都有很强的氧化性,
,它们都有很强的氧化性,
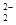 和O
和O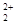 互为等电子体,所以可以推断O
互为等电子体,所以可以推断O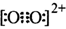
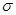 键。
键。 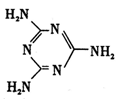
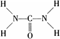
 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。
 尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。
尿素可用于制有机铁肥,主要代表物有三硝酸六尿素合铁(Ⅲ),化学式为[Fe(H2NCONH2)6](NO3)3。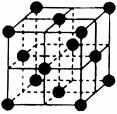
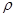 g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3
g·cm-3NA表示阿伏加德罗常数,则NaCl晶胞体积为 cm3