��Ŀ����
ͭ��̼���������ȵ���������ʵ���ҪԪ�ء�
��1��S��Cl��ɵ�һ�ֻ�����ķ��ӽṹ��H2O2���ƣ���˻�����ĽṹʽΪ ��
N��O��S����Ԫ�صĵ縺���ɴ�С��˳��Ϊ ��
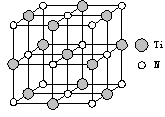
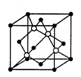
��2��ͭ�����������ڶ���ø�ĸ����ӣ��˹�ģ��ø�ǵ�ǰ�о����ȵ㡣ij������Y ��Cu(��)(���ʾ���ϼ�Ϊ��1)����γ�ͼ��ʾ�����ӣ�
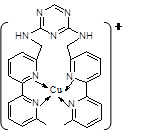
��д��Cu(��)�ĵ����Ų�ʽ ��
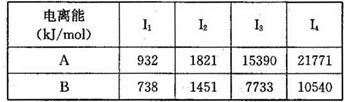
�ڸ������к��л�ѧ���������� ��ѡ����ţ���
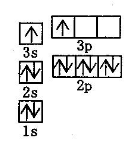
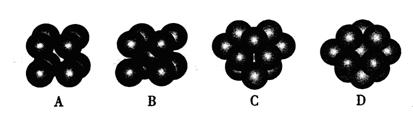
�۸�������Cԭ�ӵ��ӻ���ʽ�� ��
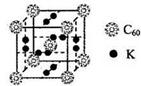
��3�����Ȼ�ͭ��Һ��ͨ�������Ķ����������ɰ�ɫ����M��M�Ľṹ��ͼ��ʾ��д���÷�Ӧ�����ӷ���ʽ ��

��1��S��Cl��ɵ�һ�ֻ�����ķ��ӽṹ��H2O2���ƣ���˻�����ĽṹʽΪ ��
N��O��S����Ԫ�صĵ縺���ɴ�С��˳��Ϊ ��
��2��ͭ�����������ڶ���ø�ĸ����ӣ��˹�ģ��ø�ǵ�ǰ�о����ȵ㡣ij������Y ��Cu(��)(���ʾ���ϼ�Ϊ��1)����γ�ͼ��ʾ�����ӣ�
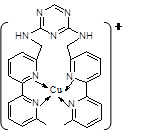
��д��Cu(��)�ĵ����Ų�ʽ ��
�ڸ������к��л�ѧ���������� ��ѡ����ţ���
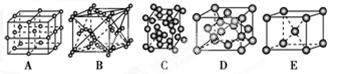
| A�����Լ� | B�����Ӽ� | C���Ǽ��Լ� | D����λ�� |
��3�����Ȼ�ͭ��Һ��ͨ�������Ķ����������ɰ�ɫ����M��M�Ľṹ��ͼ��ʾ��д���÷�Ӧ�����ӷ���ʽ ��

��1��Cl��S��S��Cl��2�֣� O��N��S����O��N��S����2�֣�
��2����1s22s22p63s23p63d10����[Ar]3d10����2�֣�
��A��C��D��2�֣����������1�֣����������2�֣���1������1�֣�
��sp2 sp3��2�֣�
��3��2Cu2+��2Cl����SO2��2H2O��2CuCl��+SO42��+4H+��2�֣�
���������
��1��H2O2�ķ��ӽṹH��O��O��Hl����������O-H�����ɵ���������ֱ�ߣ�������O��Sλ��ͬһ������������ԣ��ʽṹΪCl��S��S��Cl��N��OԪ��λ��ͬһ���ڵ縺��������ǿ��O��SԪ��λ��ͬ����縺�����ν��ͣ����Ե縺���ɴ�С��˳��ΪO��N��S��
��2��Cu(��)ָ����ͭԭ��ʧȥ��һ�����ӣ�����������Ų�ʽΪ1s22s22p63s23p63d10����[Ar]3d10����
�ڸ��ݳɼ��������жϻ�ѧ�������ͳ���û�����Ӽ�������ѡ��С��۸�������Cԭ�Ӵ����ڱ�����һ�����У��ڱ�����C��������sp2 �ӻ����ڼ���C�������� sp3���ӻ���ʽ��
��3����ͼ11���Կ������ó��������Ӧ��������Ԫ����ɣ��þ��������������Լ���Ϊ��С����4����������8*1/8+6*1/2=4������������Ԫ����������Ϊ1��1���ó������Ȼ�ͭ��Һ��ͨ�������Ķ�������Ӧ���ɣ�Cu2+��ǿ�������ԣ�SO2���л�ԭ�ԣ�������Ӧ����Cu+��SO42-���ɣ��dz���ֻ����Cu+��Cl-��϶��ɵġ����Ը���������ԭԭ����д����Ϊ2Cu2+��2Cl����SO2��2H2O��2CuCl��+SO42��+4H+��

��ϰ��ϵ�д�
�����Ŀ

 ��O
��O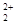 ��Ϊ�ȵ����壬���Կ����ƶ�O
��Ϊ�ȵ����壬���Կ����ƶ�O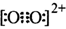
 ����
���� 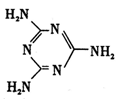
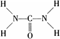 ���ؿ��������л����ʣ���Ҫ�������������������غ���������ѧʽΪ��Fe��H2NCONH2��6�ݣ�NO3��3��
���ؿ��������л����ʣ���Ҫ�������������������غ���������ѧʽΪ��Fe��H2NCONH2��6�ݣ�NO3��3��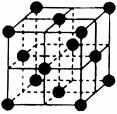
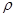 g��cm-3NA��ʾ�����ӵ���������NaCl�������Ϊ cm3
g��cm-3NA��ʾ�����ӵ���������NaCl�������Ϊ cm3
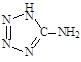 ���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�
���м������Ga���õ�������һ���������巢������������������ȫ���ҡ�