题目内容
(18分)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测为是钛(22Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)铁元素位于元素周期表的 区;其基态原子的电子排布式为 。
(2)铜原子的价电子排布式为 ,画出配离子[Cu(H2O)4]2+中的配位键____ _______。
(3)二氧化碳分子的立体构形为 形,其中C原子的杂化方式为 杂化,二氧化碳分子中含有 个σ键和 个π键。
(4)氨分子属于 分子(填“极性”或“非极性”);氨极易溶于水最主要的原因是氨分子和水分子之间可以形成 。
(5)下列元素的第一电离能最大的是( )
A.Be B.C C. N D.O
(6)下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.XeF2 B.BeCl2 C.PCl3 D.CHCl3
(7)下列晶体中,熔点最高的是 。
A.金刚石 B.干冰 C.铝 D.氯化钠

(8)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如上图,它的化学式是 。
(1)铁元素位于元素周期表的 区;其基态原子的电子排布式为 。
(2)铜原子的价电子排布式为 ,画出配离子[Cu(H2O)4]2+中的配位键____ _______。
(3)二氧化碳分子的立体构形为 形,其中C原子的杂化方式为 杂化,二氧化碳分子中含有 个σ键和 个π键。
(4)氨分子属于 分子(填“极性”或“非极性”);氨极易溶于水最主要的原因是氨分子和水分子之间可以形成 。
(5)下列元素的第一电离能最大的是( )
A.Be B.C C. N D.O
(6)下列分子中,所有原子都满足最外层为8电子结构的是 ( )
A.XeF2 B.BeCl2 C.PCl3 D.CHCl3
(7)下列晶体中,熔点最高的是 。
A.金刚石 B.干冰 C.铝 D.氯化钠

(8)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定;偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如上图,它的化学式是 。
(1)d,1s22s22p63s23p63d64s2; (2)3d10 4s1,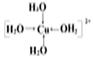 ; (3)直线,sp3,2,2;
; (3)直线,sp3,2,2;
(4)极性,氢键; (5)C; (6)C; (7)A; (8)BaTiO3。
 ; (3)直线,sp3,2,2;
; (3)直线,sp3,2,2;(4)极性,氢键; (5)C; (6)C; (7)A; (8)BaTiO3。
试题分析:(1)铁的外围电子排布是3d64s2,属于d区,其基态电子排布式为1s2 2s2 2p6 3s2 3p6 3d6 4s2。
(2)铜的价电子排布式为3d10 4s1,[Cu(H2O)4]2+中4个H2O与Cu2+配位,所以配位键结构为
 。
。(3)CO2里的中心原子C没有孤对电子,有2个σ键,所以价层电子对数为2,C原子是sp杂化,VSEPR构型为直线型,立体构型也是直线型。CO2的结构式为O=C=O,所以分子中含有2个σ键和2个π键。
(4)NH3是三角锥构型,不完全对称,属于极性分子,NH3和H2O可以形成分子间氢键,所以极易溶于水。
(5)同周期原子序数越大,第一电离能越大,其中IIA和IIIA族反常,VA和VIA族反常。则第一电离能最大的是N。
(6)对于ABn型化合物,所以原子都满足最外层8电子稳定结构,分子中一定不能含有氢,且A的最外层电子数+n×B的单电子数=8。因此PCl3分子中所有的原子都满足最外层8电子稳定结构。
(7)熔点:原子晶体>离子晶体>分子晶体,金属晶体的熔沸点差别太大。所以熔点最高的是金刚石。
(8)根据均摊法计算晶胞粒子个数可知,该晶胞中有Ba 1个Ti 1个O 3个,所以化学式为BaTiO3。
点评:本题综合性强,但是考点基础,难度小。

练习册系列答案
相关题目
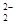 和O
和O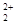 互为等电子体,所以可以推断O
互为等电子体,所以可以推断O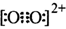
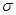 键。
键。 






 和
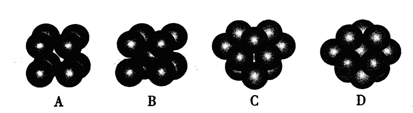
和 代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。
代表两种不同的粒子。E与D形成的化合物的晶胞是下列中的 (填序号),在该晶胞中阳离子的配位数为 。




