题目内容
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D原子核外哑铃形原子轨道上有2个未成对电子,D与A形成的化合物分子构型是V型。B元素是形成化合物种类最多的元素,A、B的最外层电子数之和与C的最外层电子数相等,F是同周期第一电离能最小的元素。
(1)写出C元素基态原子的价电子排布式 ;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示) ;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是 ;C、D分别与A形成最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会 (填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为 ,C3—中心原子采用 杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因: 。
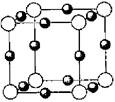
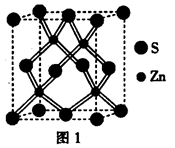
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为 (用r表示B的原子半径,用带r的表达式表示,不必简化)

(1)写出C元素基态原子的价电子排布式 ;B、C、D三种元素电负性由大到小的顺序为(用元素符号表示) ;
(2)E与A能形成分子式为EA的化合物。接近EA沸点的EA蒸气的相对分子质量测量值要大于其分子计算值,原因是 ;C、D分别与A形成最简单分子中,稳定性较高的是 (填化学式)分子;该分子再与A+结合成离子时,ACA键的键角会 (填“变大”、“不变”或“变小”)
(3)C与F形成的化合物FC3中,C3的空间构型为 ,C3—中心原子采用 杂化。灼烧FC3时,火焰呈现特殊颜色,请从原理上解释产生该现象的原因: 。
(4)右图为B元素的某种单质晶体的晶胞,则该晶体中B原子的空间占有率为 (用r表示B的原子半径,用带r的表达式表示,不必简化)

(1)2s22p3 O>N>C
(2)HF分子间通过氢键作用形成(HF)n分子,使相对分子质量增大 H2O
(3)直线型 在加热条件下,低能级电子跃迁到高能级,不稳定,电子由高能级跃迁回低能级,能量以光波形式释放,使火焰呈现特殊颜色
(4)
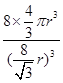 或
或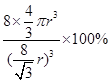
试题分析:D原子核外哑铃形原子轨道上有2个未成对电子,可知D的p轨道电子排布为:p2或者p4D与A形成的化合物分子构型是V型,则D的p轨道电子排布为:p4,D为氧元素,A为氢元素。B元素是形成化合物种类最多的元素,则B为碳元素,C为氮元素。F是同周期第一电离能最小的元素,则F为钠元素,E为氟元素。
(1)C为氮元素,价电子排布为:2s22p3,同周期元素从左至右电负性逐渐增大,所以电负性由大到小为:O>N>C。
(2)E与A能形成分子式为EA的化合物为HF,HF分子间存在很强的氢键,分子易形成多聚体(HF)n
所以相对分子质量要大于HF。C、D分别与A形成最简单分子为NH3和H2O,非金属性O>N,所以氢化物的稳定性H2O>NH3。H2O与H+形成H3O+,H2O中有两对孤对电子,而H3O+只有一对孤对电子,孤对电子数目减少,对共价键的排斥力也减小,因此H-O-H键角变大。
(3)C与F形成的化合物FC3为NaN3,N3-与CO2为等电子体,中心氮原子采取sp杂化,因此N3-空间构型为直线型。灼烧NaN3时,钠原子低能级电子跃迁到高能级形成激发态,激发态不稳定,电子又从激发态迁回基态,从高能级跃迁到低能级,放出能量,能量以光波的形式存在,使火焰呈现特殊的颜色。
(4)该原子表示的是金刚石的晶胞。通过计算一个金刚石晶胞含有碳原子数为:
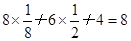 个,碳原子的半径为r,则碳原子所占的体积为V1=
个,碳原子的半径为r,则碳原子所占的体积为V1=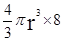 。设晶胞的边长为a,根据金刚石晶胞的结构,则
。设晶胞的边长为a,根据金刚石晶胞的结构,则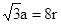 ,则
,则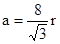 ,则晶胞的体积V=(
,则晶胞的体积V=(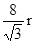 )3,则该晶体中B原子的空间占有率为:
)3,则该晶体中B原子的空间占有率为: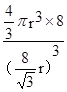 ×100%
×100%
练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目

 ,平面结构)属于________(填“极性”或“非极性”)分子。
,平面结构)属于________(填“极性”或“非极性”)分子。






 ,下列叙述正确的有 ⑤ 。
,下列叙述正确的有 ⑤ 。 键和1个
键和1个 键
键 的熔点(填>、<或=),其原因是 ⑦
的熔点(填>、<或=),其原因是 ⑦