题目内容
【化学—选:3:物质结构与性质】(15分)
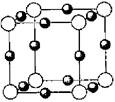
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
 请回答:
请回答:
 (1)A元素的名称是 ;
(1)A元素的名称是 ;
 (2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
 (3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :
(3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :
(4)由以上五种元素的任意两种形成的常见化合物中,所含离子键成分最多的可能为
 (5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(只要求列出算式)。
 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大。A与其他4种元素既不在同一周期又不在同一主族。B和C属同一主族,D和E属同一周期,又知E是周期表中1—18列中的第7列元素。D的原子序数比E小5,D跟B可形成离子化合物,其晶胞结构如右图。 请回答:
请回答: (1)A元素的名称是 ;
(1)A元素的名称是 ; (2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是
(2)B元素原子核外运动状态不同的电子数为 ,C元素原子价电子层的电子排布图为 ,B与A形成的化合物比C 与A形成的化合物沸点高,其原因是  (3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :
(3)元素E在周期表中的位置是 ,它的+2价离子的电子排布式为 :(4)由以上五种元素的任意两种形成的常见化合物中,所含离子键成分最多的可能为
 (5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是
(5) 如图所示,D跟B形成的离子化合物晶体的密度为ag·cm-3,则晶胞的体积是(只要求列出算式)。
(1)氢 (1分)
(2)9 (2分) (2分)
(2分)
HF分子间存在氢键,HCl分子间没有氢键(2分)
(3)第四周期第ⅦB族(2分) 1s22s22p63s23p63d5或[Ar]3d5 (2分)
(4)CaF2 (2分) (5)V =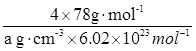 (2分)
(2分)
(2)9 (2分)
 (2分)
(2分) HF分子间存在氢键,HCl分子间没有氢键(2分)
(3)第四周期第ⅦB族(2分) 1s22s22p63s23p63d5或[Ar]3d5 (2分)
(4)CaF2 (2分) (5)V =
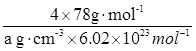 (2分)
(2分)根据元素的结构及有关性质可知,A、B、C、D和E分别是H、F、Cl、Ca、Mn。
(1)A是氢元素。
(2)F的核外电子数是9,所以就要9种不同的运动状态。氯元素的价电子是7,所以电子排布图为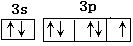 。HF分子间存在氢键,HCl分子间没有氢键,所以前者的
。HF分子间存在氢键,HCl分子间没有氢键,所以前者的
沸点高于后者。
(3)锰的原子序数是25,位于第四周期第ⅦB族。根据构造原理可知,其+2价离子的电子排布式为1s22s22p63s23p63d5或[Ar]3d5。
(4)金属性和非金属性越强,形成的化学键的离子成分就越多,五种元素中钙的顺序最强,F的非金属性最强,所以离子键成分最多的是CaF2。
(5)根据晶胞的结构可知,含有的钙离子是8×1/8+6×1/2=4,8个氟离子全部在晶胞内部,即该晶胞中含有4个CaF2,因此有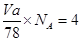 ,解得
,解得
V=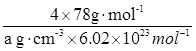
(1)A是氢元素。
(2)F的核外电子数是9,所以就要9种不同的运动状态。氯元素的价电子是7,所以电子排布图为
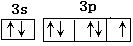 。HF分子间存在氢键,HCl分子间没有氢键,所以前者的
。HF分子间存在氢键,HCl分子间没有氢键,所以前者的沸点高于后者。
(3)锰的原子序数是25,位于第四周期第ⅦB族。根据构造原理可知,其+2价离子的电子排布式为1s22s22p63s23p63d5或[Ar]3d5。
(4)金属性和非金属性越强,形成的化学键的离子成分就越多,五种元素中钙的顺序最强,F的非金属性最强,所以离子键成分最多的是CaF2。
(5)根据晶胞的结构可知,含有的钙离子是8×1/8+6×1/2=4,8个氟离子全部在晶胞内部,即该晶胞中含有4个CaF2,因此有
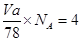 ,解得
,解得V=
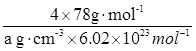

练习册系列答案
相关题目






 键和1个大
键和1个大 键,C2H2是非极性分子
键,C2H2是非极性分子




