题目内容
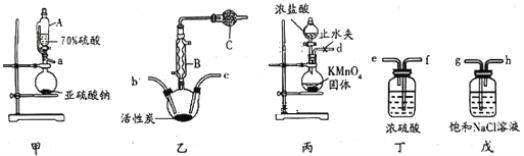
【题目】甲组同学设计的实验装置如图所示,回答下列问题:

(1)试管①中反应的化学方程式是____________ 。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是____________。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式是____________。
【答案】Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O 取下试管②并加热试管,试管内液体恢复红色 SO2+2OH-=SO32-+H2O
CuSO4+SO2↑+ 2H2O 取下试管②并加热试管,试管内液体恢复红色 SO2+2OH-=SO32-+H2O
【解析】
试管①中铜和浓硫酸在加热下发生反应,有二氧化硫气体生成,二氧化硫有漂白性,与品红生成不稳定的无色化合物,试管③中吸收二氧化硫,防止二氧化硫污染空气;
(1)试管①中铜和浓硫酸在加热下发生反应,生成硫酸铜、二氧化硫和水,则其反应的化学方程式是Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O ;
CuSO4+SO2↑+ 2H2O ;
答案为:Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O ;
CuSO4+SO2↑+ 2H2O ;
(2) 二氧化硫与品红生成不稳定的无色化合物,故能使品红溶液褪色,欲证明品红褪色的原因是SO2,取下试管②并加热试管,试管内液体恢复红色即可;
答案为:取下试管②并加热试管,试管内液体恢复红色;
(3)试管③中NaOH溶液吸收二氧化硫生成亚硫酸钠和水,反应的离子方程式是SO2+2OH-=SO32-+H2O;
答案为:SO2+2OH-=SO32-+H2O。

练习册系列答案
相关题目