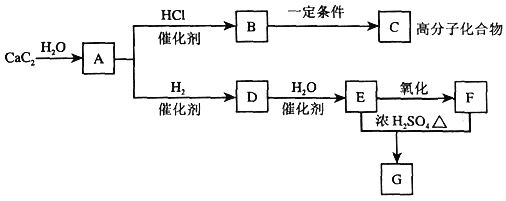
题目内容
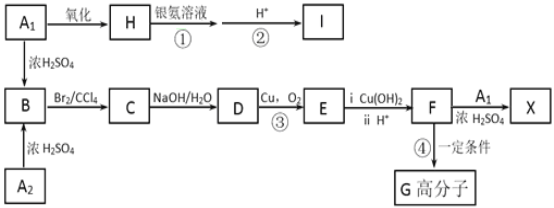
【题目】下图中A~J均代表无机物或其水溶液,其中A是红色固体,H是生活中常见的液体,J是磁性材料,而B、D、G是单质,B是地壳中含量最高的金属元素,G是气体。根据图示回答问题:
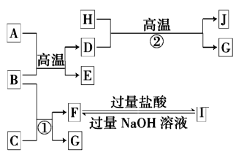
(1)写出下列物质的化学式:A_______,I___________。
(2)反应②的化学方程式是____________。
(3)上述物质D可与硫酸反应生成FeSO4,利用FeSO4可制得一种高效净水剂。方程式如下,若FeSO4和O2的化学计量数之比为2∶1,试配平下列方程式______:FeSO4+K2O2→K2FeO4+K2O+K2SO4+O2↑。
(4)高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾作为水处理剂发挥的作用是____、____。
(5)氧化铁是重要工业颜料,用废铁屑制备氧化铁的流程如下:回答下列问题:
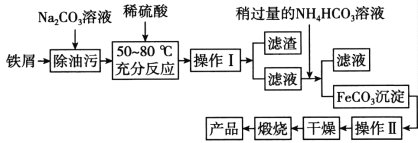
①操作I、Ⅱ的名称分别是_____、_________。
②加入NH4HCO3溶液后过滤,所得滤液的主要成份是:_________。
③写出在空气中锻烧FeCO3的化学方程式________;
(6)有些同学认为KMnO4溶液滴定也能进行铁元素含量的测定:a.称取2.850g绿矾 (FeSO4·7H2O)产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为 20.00mL。计算上述样品中FeSO4·7H2O的质量分数为_____。
【答案】Fe2O3 AlCl3 3Fe + 4H2O(g) ![]() Fe3O4 + 4H2 2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑ 强氧化性 吸附净水 过滤 洗涤 硫酸铵 4FeCO3 + O2
Fe3O4 + 4H2 2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑ 强氧化性 吸附净水 过滤 洗涤 硫酸铵 4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2 97.54%
2Fe2O3 + 4CO2 97.54%
【解析】
J是磁性材料即为四氧化三铁,推出D为铁,H为水,G为氢气,B是地壳中含量最高的金属元素即为铝,根据A和B反应,和A的颜色,推出A为氧化铁,G是气体,根据F到I的反应可知F为偏铝酸根,I为铝离子,C为强碱。
纯碱主要是利用水解原理去除油污,铁和稀硫酸反应生成硫酸亚铁,过滤后,向滤液中加入过量的碳酸氢铵,发生反应生成碳酸亚铁、硫酸铵、二氧化碳气体,再过滤洗涤干燥,再空气中煅烧得到氧化铁。
⑴写出下列物质的化学式A:Fe2O3,I:AlCl3,
故答案为Fe2O3;AlCl3;
⑵反应②是铁和水蒸气再高温下反应,其化学方程式是3Fe + 4H2O(g) ![]() Fe3O4 + 4H2,
Fe3O4 + 4H2,
故答案为3Fe + 4H2O(g) ![]() Fe3O4 + 4H2;
Fe3O4 + 4H2;
⑶若FeSO4和O2的化学计量数之比为2∶1,利用化合价升降守恒,2个铁升高8个价态,得到1个氧气升高2个价态,共升高10个价态,降低也应该降低10个价态,因此方程式配平为2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑,
故答案为2FeSO4+6K2O2 == 2K2FeO4+2K2O+2K2SO4+O2↑;
⑷高铁酸钾(K2FeO4)作为高效的绿色水处理剂,在水中发生反应生成Fe(OH)3,高铁酸钾化合价降低,具有强的氧化性,生成的氢氧化铁胶体具有吸附性,吸附水中的杂质,因此高铁酸钾作为水处理剂发挥的作用是强氧化性、吸附净水,
故答案为强氧化性;吸附净水;
⑸①根据操作I后面滤渣可推出该步骤为过滤,根据操作Ⅱ后面干燥可知该步骤为洗涤,
故答案为过滤;洗涤;
②加入NH4HCO3溶液和硫酸亚铁反应生成碳酸亚铁和硫酸铵,所得滤液的主要成份是硫酸铵,
故答案为硫酸铵;
③在空气中锻烧FeCO3的反应生成氧化铁和二氧化碳气体,其化学方程式4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2,
2Fe2O3 + 4CO2,
故答案为4FeCO3 + O2 ![]() 2Fe2O3 + 4CO2;
2Fe2O3 + 4CO2;
⑹5FeSO4 ——KMnO4,根据关系得出硫酸亚铁的物质的量![]() ,
,
质量分数为![]() ,
,
故答案为97.54%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】补齐下列物质间的反应与对应反应类型的连线。
A. 从乙烯得到聚乙烯的反应 | a. 氧化反应 |
B. 乙醇与酸性重铬酸钾溶液反应 | b. 加聚反应 |
C. 乙烯与溴的四氯化碳溶液反应 | c. 取代反应 |
D. 乙酸和乙醇在浓硫酸作用下的反应 | d. 加成反应 |