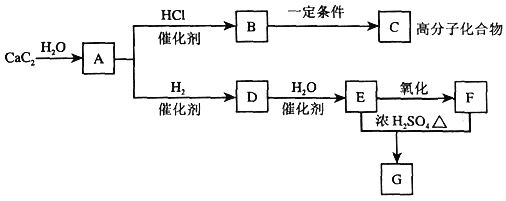
题目内容
【题目】Ⅰ.某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重9g,氢氧化钠溶液增重35.2g。该有机物的分子式为______。
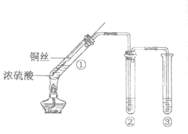
Ⅱ.为了证明溴乙烷中存在溴原子,某同学设计如下实验:
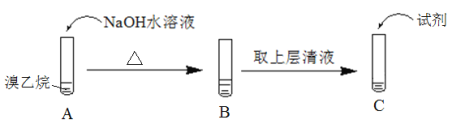
①将试管C中加入的试剂及相应的实验现象补充完整:_________。
②溴乙烷在NaOH水溶液中反应的化学方程式是_____________。
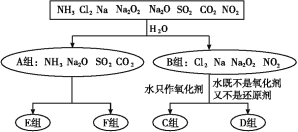
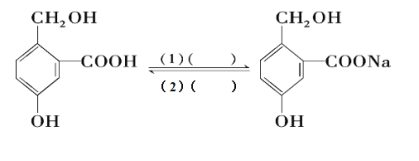
Ⅲ.为实现以下各步转化,请在下列括号中填入适当试剂。______、______
【答案】C8H10 加入足量稀HNO3调至酸性,再加入AgNO3溶液,有浅黄色沉淀生成 CH3CH2Br+NaOH![]() CH3CH2OH+NaBr NaHCO3溶液 稀HCl或稀H2SO4
CH3CH2OH+NaBr NaHCO3溶液 稀HCl或稀H2SO4
【解析】
I.浓硫酸增重9g,是吸收的水蒸气的质量,氢氧化钠溶液增重35.2g,是吸收的二氧化碳的质量,计算出生成的水和二氧化碳的物质的量,再结合原子守恒分析判断1个分子中含有的C和H,确定化学式;
II.溴乙烷在NaOH水溶液发生水解生成乙醇、NaBr,需要在试管C中检验溴离子;
Ⅲ.-COOH与Na、NaOH、Na2CO3、NaHCO3反应可以转化为-COONa,结合醇羟基和酚羟基的性质分析;-COONa与酸性比—COOH强的酸反应可以转化为-COOH。
I.浓硫酸增重9g,是吸收的水蒸气的质量,n(H2O)=![]() =0.5mol,氢氧化钠溶液增重35.2g, 是吸收的二氧化碳的质量,n(CO2)=
=0.5mol,氢氧化钠溶液增重35.2g, 是吸收的二氧化碳的质量,n(CO2)=![]() =0.8mol,由原子守恒可知,则该苯的同系物中含C原子为
=0.8mol,由原子守恒可知,则该苯的同系物中含C原子为![]() =8,含H原子为
=8,含H原子为![]() =10,分子式为C8H10,故答案为:C8H10;
=10,分子式为C8H10,故答案为:C8H10;
II.①要证明溴乙烷中存在溴原子,需要在试管C中加入足量稀硝酸至酸性,再加硝酸银溶液,有浅黄色沉淀生成,即可证明溴乙烷中存在溴原子,故答案为:加入足量稀硝酸至酸性,再加硝酸银溶液,有浅黄色沉淀生成;
②溴乙烷在NaOH水溶液中发生水解反应,反应的化学方程式是CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH
CH3CH2OH+NaBr,故答案为:CH3CH2Br+NaOH ![]() CH3CH2OH+NaBr;
CH3CH2OH+NaBr;
Ⅲ.由官能团变化可知,(1)的转化中醇羟基和酚羟基没有变化,则实现(1)的转化加入NaHCO3与-COOH反应;发生强酸制取弱酸的反应可实现(2)的转化,则试剂(1)为碳酸氢钠溶液,试剂(2)为稀盐酸或稀硫酸,故答案为:碳酸氢钠溶液;稀盐酸或稀硫酸。