题目内容
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
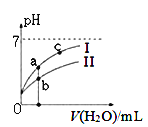
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
【答案】C
【解析】A.醋酸的电离常数大于次氯酸,所以醋酸的水解程度小于次氯酸,醋酸钠和次氯酸钠都是强碱弱酸盐,其混合溶液呈碱性,所以相同物质的量浓度的CH3COONa和NaClO的混合液中,各离子浓度的大小关系是:c(Na+>c(CH3COO-)c(ClO-> c(OH-> c(H+),A错误;B.碳酸的二级电离小于次氯酸,所以碳酸氢根离子的酸性小于次氯酸,则向NaClO溶液中通入少量二氧化碳的离子方程式:ClO-+CO2+H2O=HClO+HCO3-,B错误;C.在c(R) /c(OH)c(HR)的分子、分母同时乘以氢离子浓度可得:c(R) /c(OH)c(HR)=K(HR)/KW,由于水的离子积和电离平衡常数只受温度影响,a、c的温度相同,则该比值相等,C正确;D、pH相等的CH3COOH、HClO,稀释相同的倍数时,较强酸中氢离子浓度小于较弱酸,则较弱酸的pH小于较强酸,酸性CH3COOH>HClO,所以a所在曲线表示CH3COOH,b所在曲线表示HClO,次氯酸的电离程度小于醋酸,所以醋酸的浓度减小,次氯酸的浓度较大,a、b两点相比,加入相同体积的水后仍然是次氯酸的浓度较大,即:图象中a点酸的浓度小于b点酸的浓度,D错误;答案选C。

 名题金卷系列答案
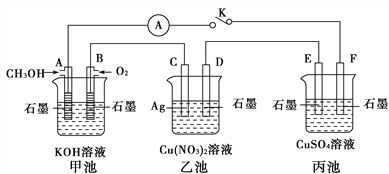
名题金卷系列答案【题目】工业上用O2将HCl转化为Cl2,可减少污染。
(1)在传统催化剂并加热条件下可实现该转化:4HCl+O2![]() 2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
已知:新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
(2)新型RuO2催化剂的使用对于平衡常数的影响是:__________(选填“变大了”、“变小了”或“无影响”)。 实验测得在一定压强下,该反应的HCl平衡转化率随温度变化的αHCl—T曲线如下图,该反应是__________(选填“放热反应”、“吸热反应”或“没有明显的放热或吸热”);A、B两点的平衡常数K(A)与K(B)中较大的是____________________。

(3)若其它条件不变,压缩体积使压强增大,则αHCl将__________(选填“增大”、“减小”或“不变”),并简要说明理由:___________________。
(4)一定条件下,2升密闭容器中,测得反应过程中n(Cl2)的数据如下:
(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的变化表示的反应速率_________________。
(5)Cl2用途广泛,写出用Cl2制备漂粉精的化学方程式:______________。
其中漂粉精的有效成分是:_________________(填物质名称),它在空气中易变质的主要原因是:_______________________。