题目内容
【题目】工业上用O2将HCl转化为Cl2,可减少污染。
(1)在传统催化剂并加热条件下可实现该转化:4HCl+O2![]() 2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
2H2O+2Cl2请标出电子转移的方向和数目__________,该反应表明氧化性:O2______Cl2(选填“>”、“<”或“=”)。若产生3.55g Cl2,转移电子的物质的量为:___________。
已知:新型RuO2催化剂对上述HCl转化为Cl2的总反应具有更好的催化活性。
(2)新型RuO2催化剂的使用对于平衡常数的影响是:__________(选填“变大了”、“变小了”或“无影响”)。 实验测得在一定压强下,该反应的HCl平衡转化率随温度变化的αHCl—T曲线如下图,该反应是__________(选填“放热反应”、“吸热反应”或“没有明显的放热或吸热”);A、B两点的平衡常数K(A)与K(B)中较大的是____________________。

(3)若其它条件不变,压缩体积使压强增大,则αHCl将__________(选填“增大”、“减小”或“不变”),并简要说明理由:___________________。
(4)一定条件下,2升密闭容器中,测得反应过程中n(Cl2)的数据如下:
(min) | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
n(Cl2)/10-3mol | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0min内以HCl的变化表示的反应速率_________________。
(5)Cl2用途广泛,写出用Cl2制备漂粉精的化学方程式:______________。
其中漂粉精的有效成分是:_________________(填物质名称),它在空气中易变质的主要原因是:_______________________。
【答案】  > 0.1mol 无影响 放热反应 K(A) 增大 当T ≥ 250℃时,水为气态,正向是气体分子个数减少的反应,增大压强,平衡右移,αHCl增大 9×10-4mol/(L●min) 2Cl2+2Ca(OH)2→ Ca(ClO)2 +CaCl2 +2H2O 次氯酸钙 次氯酸钙在空气中容易与二氧化碳反应生成次氯酸,次氯酸不稳定易见光分解,导致漂白粉失效。
> 0.1mol 无影响 放热反应 K(A) 增大 当T ≥ 250℃时,水为气态,正向是气体分子个数减少的反应,增大压强,平衡右移,αHCl增大 9×10-4mol/(L●min) 2Cl2+2Ca(OH)2→ Ca(ClO)2 +CaCl2 +2H2O 次氯酸钙 次氯酸钙在空气中容易与二氧化碳反应生成次氯酸,次氯酸不稳定易见光分解,导致漂白粉失效。
【解析】 (1).该反应中氯元素化合价由-1升高到0,氧元素化合价由0降到-2,所以氯化氢中4个氯原子共失去4个电子,氧气中2个氧原子共得到4个电子,所以该反应中电子转移的方向和数目可表示为:  该反应中氧气是氧化剂,氯气是氧化产物,所以氧化性:O2 > Cl2。若产生3.55g Cl2,则氯气的物质的量为0.05mol,由上式可知电子数与氯气分子数之比为2:1,所以转移电子的物质的量为:0.1mol。
该反应中氧气是氧化剂,氯气是氧化产物,所以氧化性:O2 > Cl2。若产生3.55g Cl2,则氯气的物质的量为0.05mol,由上式可知电子数与氯气分子数之比为2:1,所以转移电子的物质的量为:0.1mol。
(2). 催化剂对可逆反应的正、逆反应的速率的影响是相同的,所以新型RuO2催化剂的使用对于平衡常数的影响是:无影响。由αHCl—T曲线可知,温度升高氯化氢的转化率变小说明温度升高化学平衡向逆反应方向移动,所以逆反应为吸热反应,因此该反应的正反应是放热反应;反应物的转化率越高则反应向正反应方向进行的程度越大,平衡常数也就越大,所以A、B两点的平衡常数K(A)与K(B)中较大的是K(A)。
(3). 因为正反应是气体体积减小的反应,所以若其它条件不变,压缩体积使压强增大,化学平衡向正反应方向移动,则αHCl将增大,理由:当T ≥ 250℃时,水为气态,正向是气体分子个数减少的反应,增大压强,平衡右移,αHCl增大 。
(4). 2.0~6.0min内以HCl的变化表示的反应速率v(HCl)=2v(Cl2)=2![]() =2
=2![]()
![]() =2
=2![]() = 9×10-4mol/(L●min)。
= 9×10-4mol/(L●min)。
(5).用Cl2制备漂粉精的化学方程式:2Cl2+2Ca(OH)2→ Ca(ClO)2 +CaCl2 +2H2O 。
其中漂粉精的有效成分是:次氯酸钙 ,它在空气中易变质的主要原因是:次氯酸钙在空气中容易与二氧化碳、水反应生成次氯酸,次氯酸不稳定易见光分解,导致漂白粉失效。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
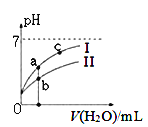
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
【题目】(1) 工业上利用CO2生产甲醇燃料,反应方程式为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。
CH3OH(g)+H2O(g)ΔH=-49.0 kJ·mol-1。将6 mol CO2和8 mol H2充入容积为2 L的密闭容器中(温度不变),H2的物质的量随时间变化如下图实线所示(图中字母后的数字表示对应坐标)。

①该反应在0-8 min内CO2的平均反应速率为_______。
②第12 min后,保持温度不变,向该密闭容器中再充入1 mol CO2(g)和3 mol H2O(g),则v正_____v逆(填“>”、“<”或“=”)。
③仅改变某一条件再进行实验,测得H2物质的量变化如上图虚线所示。与实线相比,曲线Ⅰ改变的条件可能是______,曲线Ⅱ改变的条件可能是________。
④在一定温度下,在容积为2L的两个相同密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物 投入量 | 1molCO2、3molH2 | xmolCO2、ymolH2、zmolCH3OH(g)、zmolH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则z的取值范围为______。
(2)①将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈_______性,该溶液中各离子浓度由大到小的顺序为:________________,所得溶液中c(H+)-c(OH-)=___________(填写表达式)(已知:H2SO3:Ka1=1.7×10﹣2,Ka2=6.0×10﹣8,NH3H2O:Kb=1.8×10﹣5)
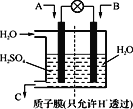
②采用下图装置将SO2转化为重要化工原料。若A为SO2,B为O2,则A为_____极,该极电极反应式为_______________。