题目内容
【题目】肼(N2H4)是一种高能燃料,在工业生产中用途广泛。
(1)肼(N2H4)也可与NO2发生反应,产物均不污染环境。请写出反应方程式:____________________。
(2)肼性质与氨气相似,易溶于水,可发生如下电离过程:
N2H4 + H2O ![]() N2H5+ + OH- I N2H5+ +H2O
N2H5+ + OH- I N2H5+ +H2O ![]() N2H62+ + OH- II
N2H62+ + OH- II
① 常温下,某浓度N2H6Cl2溶液的pH为4,则该溶液中由水电离产生的c(H+)为__________。
② 已知在相同条件下过程I的进行程度大于N2H5+的水解程度。常温下,若0.2 mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,则此时溶液呈_________性,溶液中N2H5+、Cl-、OH-、H+、N2H4浓度由大到小的顺序为___________________。

(3)肼和氧气在不同温度和催化剂条件下生成不同产物(如图):
温度较低时主要发生反应a:N2H4(g)+O2(g)![]() N2(g)+2H2O(g)
N2(g)+2H2O(g)
温度较高时主要发生反应b:N2H4(g)+2O2(g)![]() 2NO(g)+2H2O(g)
2NO(g)+2H2O(g)
①若反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,则K1__________K2。(填“>”、“<”或“=”)
②某温度下,容积固定的密闭容器中,下列描述可说明反应a达到平衡的是_______________。
A.v(N2)=v(N2H4)
B.c(N2H4):c(O2):c(N2)=1:1:1
C.混合气体的密度不再改变
D.体系的压强不再发生变化
E.混合气体的平均相对分子质量不再发生变化
③1000℃,反应b达到平衡时,下列措施能使容器中![]() 变大的是_______。
变大的是_______。
A.恒容条件下充入He B.增大容器体积 C.恒容条件下下充入N2H4 D.使用催化剂
【答案】 2N2H4 + 2NO2 =3N2+ 4H2O 1×10-4 mol/L 碱性 c(N2H5+)>c(Cl–)> c(N2H4) >c(OH–)>c(H+) > DE BC
【解析】(1) 肼(N2H4)也可与NO2发生反应,产物均不污染环境,因此生成物是氮气和水,反应的方程式为2N2H4 + 2NO2 =3N2+ 4H2O。(2)①常温下,某浓度N2H6C12溶液的pH为4,由题意可知:在溶液中c(H+)=10-4mol/L,就是水电离产生的H+。则该溶液中由水电离产生的c(H+)为10-4mol/L。②常温下,若0.2mol/L N2H4溶液与0.1 mol/L HCl溶液等体积混合,得到的是N2H5Cl与N2H4等浓度、等体积的混合溶液,由于在相同条件下过程I的进行程度大于N2H5+的水解程度,所以c(N2H5+)>c(Cl–),水解使溶液显碱性,所以c(OH–)>c(H+),盐的电离作用远大于盐电离产生的离子的水解作用,所以c(Cl–)>c(OH–),离子浓度关系是:c(N2H5+)>c(Cl–)> c(N2H4) >c(OH–)>c(H+)。(3)①由图像可知在温度高于900℃时,温度越高,达到平衡时NO的含量就越小。即升高温度,平衡逆向移动。反应b在1000℃时的平衡常数为K1,1100℃时的平衡常数为K2,所以K1>K2。②A.由于在反应方程式中氮气与肼的系数相同,所以在任何时候都存在:v(N2) = v(N2H4),因此不能说明反应达到平衡,A错误。B.在方程式中这三种物质的系数相同,所以在任何时刻都存在关系:c(N2H4): c(O2):c( N2) = 1:1:1 ,因此不能说明反应达到平衡,B错误。C.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,所以密度不再发生变化,不能说明反应达到平衡状态,C错误。D.由于该反应是反应前后气体体积不等的可逆反应,所以体系的压强不再发生变化,证明反应达到了平衡状态,D正确;E.由于反应前后气体的质量不变,若混合气体的平均相对分子质量不再发生变化,就证明混合气体的物质的量不变,则该反应达到平衡状态,E正确。答案选DE。③1000℃,反应b达到平衡时,能使容器中![]() 大,即使化学平衡正向移动。A.恒容条件下,充入He,由于反应混合物各组分的浓度不变,因此平衡不发生移动,A错误;B.增大容器体积,容器内气体的压强减小促使化学平衡正向移动,
大,即使化学平衡正向移动。A.恒容条件下,充入He,由于反应混合物各组分的浓度不变,因此平衡不发生移动,A错误;B.增大容器体积,容器内气体的压强减小促使化学平衡正向移动, ![]() 大,B正确;C.恒容条件下,充人N2H4,即增大反应物的浓度,根据平衡移动原理,增大反应物的浓度,平衡正向移动,
大,B正确;C.恒容条件下,充人N2H4,即增大反应物的浓度,根据平衡移动原理,增大反应物的浓度,平衡正向移动, ![]() 大,C正确;D.使用催化剂能够加快反应速率,缩短达到平衡所需要的时间,但是平衡不发生移动,因此
大,C正确;D.使用催化剂能够加快反应速率,缩短达到平衡所需要的时间,但是平衡不发生移动,因此![]() 不变,D错误。答案选BC。
不变,D错误。答案选BC。

【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
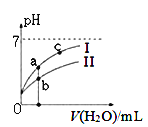
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度