题目内容
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中只有T为金属元素。
下列判断错误的是
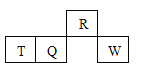
A. 原子半径:T > Q
B. 元素非金属性:Q > R
C. 气态氢化物的热稳定性:R>Q
D. 最高价氧化物对应水化物的酸性: W > Q
【答案】B
【解析】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,T、Q、W位于第三周期,其中只有T为金属元素,则T为Al元素,根据相对位置可知Q为Si元素、W为S元素、R为N元素,则A.同一周期中,原子序数越大,原子半径越小,则原子半径T>Q,A正确;B.Q为Si、R为N元素,最高价含氧酸硝酸的酸性大于硅酸,则N的非金属性较强,即元素非金属性:Q<R,B错误;C.非金属性越强,氢化物稳定性越强,则气态氢化物的热稳定性:R>Q,C正确;D.非金属性越强,最高价含氧酸的酸性越强,非金属性Q<W,则最高价氧化物对应水化物的酸性:W>Q,D正确;答案选B。

【题目】下表是元素周期表一部分,列出了九种元素在周期表中的位置:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请用化学用语回答下列问题
(1)在上述元素中,金属性最强的是________。
(2)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是________(填物质化学式)。写出⑥和⑧的最高价氧化物对应的水化物反应的离子方程式________。
(3)只由④形成的18电子微粒。________。
(4)写出②的最高价氧化物的电子式________。
(5)用电子式表示⑦和⑨形成的化合物的形成过程________。
<>(6)表中元素③和⑤可形成一种相对分子质量为66的共价化合物Y,Y分子中各原子均达到“8电子稳定结构”,Y的结构式________。
【题目】已知:下表为25℃时某些弱酸的电离平衡常数。
CH3COOH | HClO | H2CO3 |
Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7 Ka2=4.7×10-11 |
下图表示常温下,稀释CH3COOH、HClO两种酸的稀溶液时,溶液pH随加水量的变化。下列说法正确的是 ( )
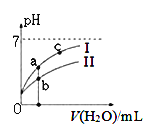
A. 相同浓度的CH3COONa和NaClO的混合溶液中,各离子浓度的大小关系是:c(Na+) > c(ClO-)> c(CH3COO-)> c(OH-)> c(H+)
B. 向NaClO溶液中通入少量二氧化碳的离子方程式为: ClO-+CO2+ H2O =HClO+CO32-
C. 图像中a、c两点处的溶液中![]() 相等(HR代表CH3COOH或HClO)
相等(HR代表CH3COOH或HClO)
D. 图像中a点酸的总浓度大于b点酸的总浓度
