题目内容
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
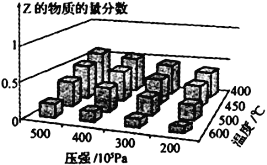
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)![]() CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
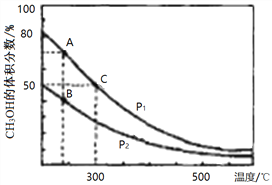
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率 | 平衡常数K | 平衡转化率α |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
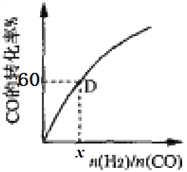
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。
【答案】 Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1 B C B 正反应 3 3 ≤pH<5 向一份溶液中加入KSCN溶液,溶液变为血红色;向另一溶液中加入铁氰化钾溶液,产生特征蓝色沉淀
2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1 B C B 正反应 3 3 ≤pH<5 向一份溶液中加入KSCN溶液,溶液变为血红色;向另一溶液中加入铁氰化钾溶液,产生特征蓝色沉淀
【解析】(1)根据盖斯定律:②×3-(①×3-③),整理得到CO还原Fe2O3的热化学方程式. Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1;正确答案:Fe2O3(s)+3CO(g)
2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1;正确答案:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1。
2Fe(s)+3CO2(g) △H=-23.5 kJ/mol-1。
(2)①从图像可知,温度升高,甲醇的体积分数减小,该反应为放热反应;升高温度,平衡左移,平衡常数K减小,C点最小;从曲线图看出, A状态下体积小,甲醇体积分数大;B状态下体积大,甲醇体积分数小;A曲线相对于B曲线来说,相当于加压,平衡右移,平衡转化率B点最小,由于B点对应温度低,物质的浓度小,反应速率慢,正确选项B 、C 、 B。
②恒容密闭容器中分别充入1molCO和2mol H2,发生CO(g)+2H2(g)![]() CH3OH(g) 反应,达到平衡时CH3OH的体积分数为50%,设CH3OH的量为xmol.假设容器的体积为1L;
CH3OH(g) 反应,达到平衡时CH3OH的体积分数为50%,设CH3OH的量为xmol.假设容器的体积为1L;
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 1 2 0
变化量 x 2x x
平衡量 1- x 2-2x x
50%= x/(1- x+2-2x+x), x=0.75 mol;该反应平衡常数为0.75/0.25×0.52=12;在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应的各物质的量分别为0.75molCO、1.5 mol H2、1.25 molCH3OH,该反应的浓度商为1.25/0.75×1.52=0.74<12,反应正反应方向进行;正确答案:正反应。
③根据反应方程式:设n(H2)/n(CO)= x,CO的起始量为amol, H2的量为a x mol,
CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
起始量 a a x 0
变化量 0.6 a 1.2a 0.6a
已知D点氢气的转化率为40%,1.2 a/ a x=40%, 解之x=3;所以n(H2)/n(CO)=3;正确答案:3。
(3)KspFe(OH)3=c(Fe3+)×c3(OH-)=4×l0-38, 已知c(Fe3+)≤4×l0-5,则c,(OH-)= l0-11,c,(H+)=10-3,pH≥3;KspCu(OH)2= c(Cu2+)×c2(OH-) =2.6×l0-19,已知c c(Cu2+)=0.26mol·L-1,则c(OH-)= l0-9,c(H+)=10-5,pH=5,因此欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为3 ≤pH<5 ;正确答案:3 ≤pH<5。
(4)证明莫尔盐已经部分氧化,需要检验盐中含有亚铁离子和铁离子,铁离子检验可用硫氰化钾溶液;亚铁离子检验可以用铁氰化钾溶液;正确答案:向一份溶液中加入KSCN溶液,溶液变为血红色;向另一溶液中加入铁氰化钾溶液,产生特征蓝色沉淀。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】通过沉淀-氧化法处理含铬废水,减少废液排放对环境的污染,同时回收K2Cr2O7。实验室对含铬废液(含有Cr3+、Fe3+、K+、SO42-、NO3-和少量Cr2O72-)回收与再利用工艺如下:
已知:①Cr(OH)3+OH-=CrO2-+2H2O; ②2CrO2-+3H2O2+2OH-=2CrO42-+4H2O;M(Cr)=52
③H2O2在酸性条件下具有还原性,能将+6价Cr还原为+3价Cr。

(1)抽滤过程中要及时观察吸滤瓶内液面高度,当快达到支管口位置时应进行的操作为_____________________________。
(2)滤液Ⅰ酸化前,进行加热的目的是____________________________;
冰浴、过滤后,应用少量冷水洗涤K2Cr2O7,其目的是________________________。
(3)下表是相关物质的溶解度数据:
物质 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | 100℃ |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 | 56.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 | 24.1 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 | 102.0 |
KNO3 | 13.9 | 31.6 | 61.3 | 106 | 167 | 246.0 |
根据溶解度数据,调节pH选择的试剂是__________________。
A.稀盐酸 B.稀硫酸 C.稀硝酸
操作Ⅰ具体操作步骤为①______________________、②____________________。
(4)称取产品重铬酸钾试样4.000g配成250mL溶液,取出25.00mL于锥形瓶中,加入10mL 2 mol·L-1H2SO4和足量碘化钠(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入3mL淀粉指示剂,用0.2400 mol·L-1Na2S2O3标准溶液滴定(I2+2S2O32-=2I-+S4O62-)。
① 若实验中共用去Na2S2O3标准溶液30.00mL,所得产品的中重铬酸钾的纯度为__________________________(列式不计算,设整个过程中其它杂质不参与反应)。
② 若装Na2S2O3标准液的滴定管在滴定前有气泡滴定后没有气泡,测得的重铬酸钾的纯度将:______________________(填“偏高”、“偏低”、或“不变”)。