题目内容
【题目】在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
A.将SO2通入水中B.硫酸氢钠溶于水
C.将HCl通入水中D.烧碱溶于水
【答案】B
【解析】
A.二氧化硫和水反应生成亚硫酸,只有共价键被破坏和形成,选项A不符合题意;
B.硫酸氢钠溶于水后电离出氢离子、钠离子和硫酸根离子,既有离子键被破坏又有共价键被破坏,选项B符合题意;
C.氯化氢溶于水后电离出氢离子和氯离子,只有共价键被破坏,选项C不符合题意;
D.烧碱溶于水后电离出钠离子和氢氧根离子,只有离子键被破坏,选项D不符合题意;
答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】下列有关物质检验的实验结论正确的是
选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 Fe2+ |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
D | 某钾盐溶于盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 该钾盐是K2CO3 |
A. A B. B C. C D. D
【答案】B
【解析】
白色沉淀可能为AgCl;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫;先加入硫氰化钾溶液,溶液不显示红色,说明溶液中不存在铁离子,再加入具有氧化性的氯水,溶液变成红色,说明原溶液中一定存在亚铁离子;能使品红褪色的气体不一定为SO2;产生的气体能使澄清石灰水变浑浊,气体为二氧化碳或二氧化硫。
白色沉淀也可能为AgCl,若先加盐酸排除干扰,不生成沉淀,再加氯化钡生成沉淀,则溶液中一定含有SO42-,A错误;向某溶液中加入2滴KSCN溶液,溶液不显红色,说明溶液中不存在铁离子;再向溶液中加入几滴新制的氯水,溶液变为红色,说明加入氯水后溶液中出现了铁离子,证明原溶液中一定含有Fe2+,B正确;能使品红褪色的气体不一定为SO2,也可能为其它强氧化性气体,如氯气、臭氧等,C错误;产生的气体能使澄清石灰水变浑浊,气体可能为二氧化碳或二氧化硫,则溶液中可能含有CO32-、HCO3-,或SO32-、HSO3-,D错误。
【点睛】
本题考查化学实验方案的评价,侧重分析与实验能力的考查,注意实验的评价性分析,把握常见离子的检验、物质的性质、气体的检验等为解答的关键。
【题型】单选题
【结束】
17
【题目】在铜与浓硫酸的反应中,如果转移0.4mol电子,则被还原的硫酸物质的量
A. 0.4mol B. 0.2mol
C. 小于0.4mol D. 小于0.2 mol
【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)![]() CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
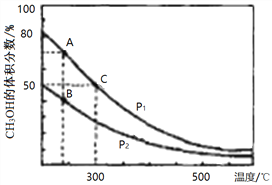
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率 | 平衡常数K | 平衡转化率α |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
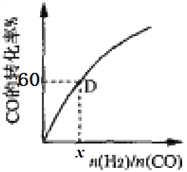
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。