题目内容
【题目】(1)选择下列实验方法分离物质,将分离方法的序号填在横线上。
A.萃取分液 B.升华 C.结晶 D.分液 E.蒸馏 F.过滤
①______分离饱和食盐水与沙子的混合物。
②______分离稀硫酸和汽油的混合物。
③______从溴水中提取溴。
(2)在标准状况下,下列物质:
①4 g H2,②33.6 L CH4,③1.6 mol H2O,其中所含分子数最多的是__________(填序号,下同);体积最小的是_________。
【答案】FDA①③
【解析】
(1)①饱和食盐水与沙子为固体与液体不互溶的混合物,可用过滤方法分离,故答案为:F;
②稀硫酸和汽油互不相溶,可用分液的方法分离,故答案为:D;
③溴不易溶于水,易溶于有机溶剂,则选萃取分液法从溴水中提取溴,故答案为:A;
(2)在标准状况下,①4gH2的物质的量为![]() =2mol;体积为2×22.4=44.8L;②33.6LCH4的物质的量为
=2mol;体积为2×22.4=44.8L;②33.6LCH4的物质的量为![]() =1.5mol;③1.6molH2O的物质的量为1.6mol;质量为28.8g,标准状况下的体积约为32mL(密度约为0.9g/mL);故含分子数最多的是①;水为液体,③的体积最小;故答案为:①;③。
=1.5mol;③1.6molH2O的物质的量为1.6mol;质量为28.8g,标准状况下的体积约为32mL(密度约为0.9g/mL);故含分子数最多的是①;水为液体,③的体积最小;故答案为:①;③。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案【题目】铁及其化合物在工农业生产中有重要的作用。
(1)已知:①C(s)+O2(g)=CO2(g) △H1=-393.5kJ/mol;
②C(s)+CO2(g)=2CO(g) △H2=+172.5kJ/mol
③4Fe(s)+3O2(g)=2Fe2O3(s) △H3=-1651.0kJ/mol
CO还原Fe2O3的热化学方程式为__________________________________________。
(2)高炉炼铁产生的高炉气中含有CO、H2、CO2等气体,用CO和H2在催化剂作用下合成甲醇,是减少污染、节约能源的新举措,反应原理:CO(g)+2H2(g)![]() CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
CH3OH(g) △H。在体积不同的两个恒容密闭容器中分别充入1molCO和2mol H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图。
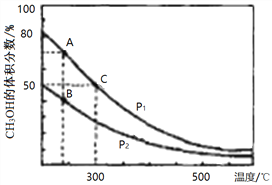
①在上图A、B、C三点中,选出对应下表物理量最小的点。
反应速率 | 平衡常数K | 平衡转化率α |
_________ | _________ | _________ |
②在300℃时,向C点平衡体系中再充入0. 5molCO、1.0molH2和0.5mol的CH3OH,该反应向_________方向进行(填“正反应”、‘逆反应”或“不移动”)。
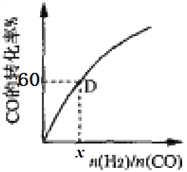
③一定温度下,CO的转化率与起始投料比[n(H2)/n(CO)]的变化关系图所示,测得D点氢气的转化率为40%,则x=_____________。
(3)三氯化铁是一种重要的化合物,可以用来腐蚀电路板。某腐蚀废液中含有0.5mol·L-1Fe3+和0.26mol·L-1的Cu2+,欲使Fe3+完全沉淀[c(Fe3+)≤4×l0-5]而Cu2+不沉淀,则需控制溶液pH的范围为_________。[KspCu(OH)2=2.6×l0-19;KspFe(OH)3=4×l0-38]
(4)莫尔盐,即六水合硫酸亚铁铵晶体,是一种重要的化工原料,在空气中缓慢风化及氧化,欲证明一瓶久置的莫尔盐已经部分氧化,需要进行实验操作是:取少量样品,加无氧水溶解,将溶液分成两份,______________________________________,则证明该样品已部分氧化。