题目内容
【题目】下列有关化学符号表征正确的是
A. 电解法精炼铜,阴极电极反应:Cu2++2e-== Cu
B. H2S在水溶液中的电离:H2S![]() 2H++ S2-
2H++ S2-
C. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (g) ΔH=-890.3 kJ·mol-1
D. 碳酸钠水解的离子方程式:CO32-+2H2O![]() 2OH-+H2CO3
2OH-+H2CO3
【答案】A
【解析】
A. 电解法精炼铜,阴极发生还原反应:
B. 二元弱酸的电离分步进行,以第一步为主;
C. 燃烧热为常温常压下,1 mol可燃物完全燃烧生成稳定氧化物所放出的热量;
D. 碳酸根离子的水解反应分步进行。
A. 电解法精炼铜,阴极溶液中的铜离子得电子发生还原反应,其电极反应式为:Cu2++2e-== Cu,故A项正确;
B. H2S在水溶液中的主要电离方程式为H2S![]() H++HS,故B项错误;
H++HS,故B项错误;
C. 甲烷燃烧的热化学方程式可表示为:CH4 (g)+2O2 (g) ==CO2 (g)+2H2O (l) ΔH=-890.3 kJ·mol-1,常温下水的稳定状态为液态,故C项错误;
D. 碳酸钠水解的离子方程式:CO32-+H2O![]() OH-+HCO3-,故D项错误;
OH-+HCO3-,故D项错误;
答案选A。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。
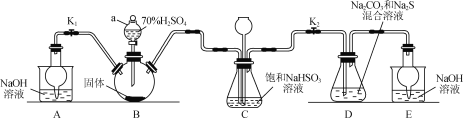
(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。