题目内容
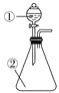
【题目】Na2S2O3可用于照相业作定影剂等。实验室可通过Na2S、Na2CO3和SO2共同反应来制备,装置如图。

(1)仪器a的名称为____。
(2)A装置中,NaOH溶液的作用是___。
(3)D中生成Na2S2O3的化学方程式为___。
(4)装置C的作用有___、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是___。
(5)本实验所需的Na2S可由硫化钠碱坯(主要含Na2S,还含少量Na2SO4、炭粉等杂质)制备。
已知Na2S的溶解度、固相成分与温度的关系如表:
温度/℃ | 溶解度/g | 固相 |
-10 | 10.3 | Na2S·9H2O+冰 |
10 | 13.6 | Na2S·9H2O |
20 | 18.7 | Na2S·9H2O |
40 | 28.5 | Na2S·9H2O |
48 | 35.7 | Na2S·9H2O+Na2S·6H2O |
60 | 39.1 | Na2S·6H2O |
80 | 49.1 | Na2S·6H2O |
91.5 | 61.3 | Na2S·6H2O+Na2S·5.5H2O |
请补充完整由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,__,得到Na2S·9H2O晶体(须用的试剂:BaS、无水乙醇)。
【答案】分液漏斗 吸收B中产生的SO2尾气,防止污染环境 2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2 安全瓶,防止装置内压强过大 减缓滴加70%H2SO4的速率 向所得滤液中加入BaS,直至白色沉淀不再增加时,过滤,将滤液蒸发浓缩、冷却至10℃时结晶,过滤,晶体用无水乙醇洗涤、烘干
【解析】
实验室可通过Na2S、Na2CO3和SO2共同反应来制备Na2S2O3;浓硫酸与亚硫酸钠固体反应制备二氧化硫(有毒,可用碱液吸收),反应产生的二氧化硫在装置D中,与Na2S、Na2CO3的混合液共同作用,生成Na2S2O3;二氧化硫与亚硫酸氢钠溶液不反应,该装置能够起到安全瓶的作用。根据图表信息,分析由硫化钠碱坯制备Na2S·9H2O晶体的实验方法。
(1)根据仪器的形状和作用,仪器a的名称为分液漏斗。
故答案为:分液漏斗;
(2)SO2尾气有毒,不能直接排放到空气中,A装置中,NaOH溶液的作用是吸收B中产生的SO2尾气,防止污染环境。
故答案为:吸收B中产生的SO2尾气,防止污染环境;
(3)Na2S在Na2CO3作用下和SO2反应生成Na2S2O3,D中生成Na2S2O3的化学方程式为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2。
故答案为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2;
(4)装置C的作用有:作安全瓶,防止装置内压强过大、观察SO2的生成速率。若观察到SO2的生成速率过快,应进行的操作是减缓滴加70%H2SO4的速率。
故答案为:安全瓶,防止装置内压强过大;减缓滴加70%H2SO4的速率;
(5)由硫化钠碱坯制备Na2S·9H2O晶体的实验方案:边搅拌边将适量蒸馏水加入硫化钠碱坯中,过滤,向所得滤液中加入BaS,直至白色沉淀不再增加时,过滤,将滤液蒸发浓缩、冷却至10℃时结晶,过滤,晶体用无水乙醇洗涤、烘干,得到Na2S·9H2O晶体。
故答案为: 向所得滤液中加入BaS,直至白色沉淀不再增加时,过滤,将滤液蒸发浓缩、冷却至10℃时结晶,过滤,晶体用无水乙醇洗涤、烘干。

 习题精选系列答案
习题精选系列答案