题目内容
(12分) X、Y、Z三种短周期元素,两两之间能组成5种化合物A、B、C、D、E;X、Y、Z三种元素可组成化合物F。已知:化合物A、B、C中原子个数比都为1︰1;B为淡黄色固体,C、E常温下均为无色液体;A是化学式为XZ的离子化合物,A与E反应生成F和一种气体;D是化学式为X2Y的离子化合物,D的阴、阳离子具有相同的电子层结构且与E分子所含电子数相等。 请回答下列问题:
(1)X元素的名称是________________。
(2)X、Y、Z的原子半径从大到小的顺序是(用元素符号表示)____________________。
(3)写出F的电子式______________________________。
(4)已知X单质、A、B、D固体,分别与E反应都生成同一种物质,其中X单质、A、B分别与E的反应均是氧化还原反应。请写出X单质、B分别与E反应的化学方程式___________, ;
B中含有的化学键是 ;请举一例说明B的用途_____________。
(5)请写出由化合物C制取Y的单质反应的化学方程式_______________________________。
(1)钠 (2) Na>O>H (3)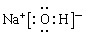
(4)2Na+2H2O=4NaOH+H2↑;2Na2O2+2H2O=4NaOH+O2↑;离子键和非极性键;作呼吸面具和潜水艇里氧气得来源 (5)2H2O2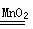 2H2O+O2
2H2O+O2
解析试题分析:(1)B为淡黄色固体可推测为Na2O2,三种元素中有Na和O。C、E常温为液体,推测为H2O2和H2O,可知三种元素还包括H。A为XZ的离子化合物,可知A为NaH,X为Na,Y为O,Z为H.则A为NaH,B为Na2O2,C为H2O2,D为Na2O,E为H2O,F为NaOH.故X元素的名称是:钠。(2)同周期从左到右半径逐渐减小,同主族从上到下逐渐增大,X、Y、Z的原子半径从大到小的顺序是(用元素符号表示):Na>O>H。
(3)F的化学式:NaOH,F的电子式: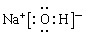 。
。
(4)X为Na,B为Na2O2,E为H2O,X单质、B分别与E反应的化学方程式:2Na+2H2O=4NaOH+H2↑、2Na2O2+2H2O=4NaOH+O2↑,B是过氧化钠,含有钠离子和过氧根离子.故含离子键,过氧根离子内两个氧原子间是非极性键。
(5)C为H2O2,Y为O,反应的化学方程式:2H2O2 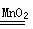 2H2O+O2↑。
2H2O+O2↑。
考点:考查元素周期表,原子结构,元素及其化合物的性质,化学键

质量数为A,核内中子数为N的R2+离子与16O所形成的Wg氧化物中所含质子的物质的量为 ( )
A. mol mol | B.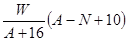 mol mol |
| C.(A-N+8)mol | D.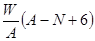 mol mol |
下列叙述中,正确的是
| A.同周期元素中,ⅦA族元素的原子半径最大 |
| B.ⅥA族元素的原子,其半径越大,越容易得到电子 |
| C.室温时,0族元素的单质都是气体 |
| D.元素周期表中,从ⅢB到ⅡB这10个纵行的元素都是副族元素 |
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:

①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | | | | ① | ② | | | |
| 3 | ③ | ④ | ⑤ | ⑥ | | ⑦ | ⑧ | ⑩ |
| 4 | | | | | | | ⑨ | |
构成有机物的主要元素是 ,构成岩石与许多矿物的基本元素是 ,
化学性质最不活泼的元素 ,气态氢化物的水溶液呈碱性的元素 。
⑵上述①~⑨元素的最高价氧化物对应的水化物中:
碱性最强的物质的电子式为 ,酸性最强的物质的化学式为 。
⑶若以元素④和⑤的单质为电极,与元素③的最高价氧化物对应的水化物的水溶液组成原电池,则④的单质在此原电池中作______极(填“正”或“负”)
⑷元素⑦的某氧化物为有刺激性气味的无色气体,其氢化物为有臭鸡蛋气味的无色气体。若这两种气体混合,会生成一种淡黄色粉末。此反应化学方程式为 。若此反应中氧化产物的质量为3.2g,则反应中转移的电子数为 (填数值)。
⑸元素⑧和元素⑨两者核电荷数之差是 ,这两种元素中非金属性较弱的元素是 (填元素名称),能说明这两种元素的非金属性强弱的实验事实是(用离子方程式表示)
。