题目内容
超铀元素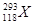 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子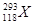 的中子数与核外电子数之差为
的中子数与核外电子数之差为
| A.0 | B.118 |
| C.57 | D.175 |
C
解析试题分析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=118,质量数=293.又因为中子数+质子数=质量数,核外电子数=质子数,所以该核素的中子数与核外电子数之差为293-118-118=57,答案选C。
考点:考查原子组成以及组成原子的几种微粒之间的计算
点评:该题是高考中的常见题型,试题以新科技、新发现为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。

练习册系列答案
相关题目
XY2是离子化合物,X和Y的离子的电子层结构与氖原子的相同,则X、Y为
| A.Na和Cl | B.K和S | C.Ca和F | D.Mg和F |
短周期元素的离子aW2+、bX+、cY2-、dZ-具有相同的电子层结构,下列推断正确的是
| A.热稳定性:H2Y<HZ | B.原子半径:W>X>Z>Y |
| C.离子半径:W2+>Y2- | D.碱性:XOH<W(OH)2 |
下列各选项中两种粒子所含电子数不相等的是
| A.羟甲基(-CH2OH)和甲氧基(CH3O-) |
| B.羟基(-OH)和氢氧根(OH-) |
| C.硝基(-NO2)和二氧化氮(NO2) |
| D.亚硝酸(HNO2)和亚硝酸根(NO2—) |
科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数与核外电子数之差为
| A.47 | B.57 |
| C.61 | D.175 |
短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族。下列叙述正确的是( )
| A.原子半径的大小顺序: Y<Z<W<X |
| B.化合物YX、ZX2、WX3中化学键的类型相同 |
| C.非金属性的强弱顺序:X>W>Z |
| D.元素W的最高价氧化物对应水化物的酸性比Z的弱 |
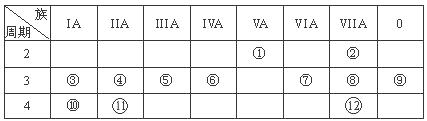
元素周期表是学习物质结构和性质的重要工具。请参照元素①-⑦在周期表中的位置,回答下列问题:
| ① | | | ||||||
| | | | | ② | ③ | ④ | | |
| ⑤ | | ⑥ | ⑦ | | | | | |
(1)元素⑦在元素周期表的位置为______________,
(2)由原子个数比为1:1:1的①、②、③ 三种元素组成共价化合物X,共形成4对共用电子对,X的结构式为 。
(3)⑥的最高价氧化物与⑤的最高价氧化物对应的水化物在溶液中进行的的离子反应方程式__________________________________。
(4)由表中两种元素的原子按1:1组成的离子化合物常用作供氧剂,该化合物中的化学键类型为_____________________。
(5)A、B、D、E是由上述部分元素组成的化合物,它们之间的转化关系如图所示(部分产物已略去)。A、B、D的焰色反应均呈黄色,水溶液均为碱性。请回答:

①E的电子式为 。
②自然界中存在B、D和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100 mL溶液,测得溶液中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至质量不再发生变化,剩余固体的质量为 g。